(考试时间100分钟,满分120分)
可能用到的相对原子质量:Ar(H)=1 Ar(O)=16 Ar(C)=12 Ar(Mg)=24 Ar(Ca)=40 Ar(Fe)=56 Ar(Cu)=64 Ar(Al)=27 Ar(N)=14 Ar(Cl)=35.5 Ar( Na)=23 Ar(K )=39 Ar( S)=32 Ar( Al)= 27 Ar( Ba)=137
一. 选择题(每题只有1个正确答案,每小题3分,共30分)
1.下表是食用碘盐包装上的部分说明,下列说法正确的是
配料
精盐、碘酸钾、抗结剂
碘含量
35±15 mg/kg
储存方法
密封、避光、防潮
食用方法
烹饪时,待食品熟后加入碘盐
A.高温会导致碘的损失 B.碘酸钾可氧化氯化钾
C.可用淀粉检验碘盐中的碘酸钾 D.该碘盐中碘酸钾含量为20~50 mg/kg
2.下列各组物质的分类正确的是
A.强碱:NaOH、CsOH、Ba(OH)2
B.非电解质:C12、NH3、C2H5OH
C.碱性氧化物:MgO、Mn2O7、NaO
![]() D.同系物:
D.同系物:
3.下列关于胶体的叙述不正确的是 ( )
A胶体中分散质的直径介于1nm~100nm之间,用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
B 光线透过胶体时,胶体发生丁达尔效应,利用丁达尔效应可以区别溶液与胶体
C 布朗运动是胶体的性质之一,布朗运动是胶体稳定的次要原因
D 胶体粒子具有较大的表面积,有的能吸附阳离子或阴离子,故在电场作用下会产生电泳现象,电泳现象可证实胶体属于电解质溶液
4、通过化学反应不能实现的是
A、生成一种新离子 B、生成一种新分子
C、生成一种新核素 D、生成一种新单质
5、配制250mL0.5mol/L的NaOH溶液,有下列仪器:①托盘天平、②量筒、③烧杯、④玻璃棒、⑤漏斗、⑥500mL容量瓶、⑦药匙、⑧250mL容量瓶、⑨胶头滴管、⑩坩埚,需要用到的仪器有
A、①③④⑥⑨⑩ B、①④⑦⑧⑨⑩ C、①③④⑦⑧⑨ D、①②④⑤⑧⑨
6、下列各组在溶液中反应,不管反应物的量是多少,都能用同一离子方程式表示的是
A.FeBr2与Cl2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.NaHCO3与Ca(OH)2
7.先将甲物质放于托盘天平右盘进行称量,再将乙物质放在左盘进行称量,若两次都使用了游码,且砝码和游码的读数均相等,甲、乙两物质的质量( )
A.小于 B.等于 C.大于 D.不能确定
8.下列说法正确的是( )
A.用25ml量筒量取12.3ml盐酸;用托盘天平称取8.75g食盐
B.用pH试纸测得某氯水的pH为2;用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10ml
C.将质量分数为5%和25%的氨水等体积混合后,所得溶液中溶质的质量分数大于15%
D.浓硝酸必须保存在棕色玻璃瓶中;用镊子取出白磷并置于水中切割
9.在饱和NaOH溶液中加入一定量Na2O2,充分反应后恢复到原温度,下列说法正确的是( )
A.有晶体析出,原溶液质量不变 B.有晶体析出,原溶剂质量不变
C.溶液仍为饱和溶液,浓度增大 D.溶液仍为饱和溶液,浓度不变
10.甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,以下说法不正确的是
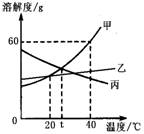 A.40℃时,100g水中最多溶解甲60g
A.40℃时,100g水中最多溶解甲60g
B.t℃时,甲与丙的溶解度相等
C.分别将40℃时甲、丙的饱和溶液降温至t℃,
所得两溶液中溶质的质量分数相等
D.甲中混有少量乙,可用降温结晶法分离提纯甲
二、选择题(每题有1-2个正确答案, 每小题4分,共32分)
11、设NA代表阿伏加德罗常数,下列说法正确的是
A.用惰性电极电解500mL饱和食盐水时,若溶液的pH值变为14时,则电极上转移的电子数目为NA
B.将162.5g FeCl3转化为氢氧化铁胶体后,氢氧化铁胶体粒子数等于6.02×1023
C.标准状况下,22.4L甲烷和乙炔混合物所含的分子数为NA
D.46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
12、下列各组离子在相应的条件下可以大量共存的是
A.在碱性溶液中:CO32—、K 、C1—、Na
B.与铝粉反应放出氢气的无色溶液中:NO3—、Mg2 、Na 、SO42—
C.在c(H )/c(OH—)==1×1012的溶液中:NH4 、Ca2 、C1—、K
D.在中性溶液中:Fe3 、S2—、NO3—、A13
13、质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为
A.等于2c mol/L B.大于2c mol/L
C.小于2c mol/L D.在c mol/L∽2c mol/L之间
14.水热法制备Fe3O4纳米颗粒的反应是3Fe2 2S2O ![]() O2 xOH—
O2 xOH— Fe3O4 S4O ![]() 2H2O,下列说法中,正确的是
2H2O,下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为4mol
B.Fe2 和S2O ![]() 都是还原剂
都是还原剂
C.1mol Fe2 被氧化时,被Fe2 还原的O2的物质的量为1/3mol
D.x=2
15、下列反应的离子方程式书写正确的是
A、碳酸氢钙溶液中加入过量的NaOH溶液:
Ca2 HCO3- OH-=CaCO3↓ H2O
B、溶液中NH4HSO3与NaOH等物质的量混合:
NH4 HSO3- 2OH-=SO32- NH3·H2O H2O
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 2Fe2 2H H2O2 =2 Fe3 2H2O
D、硫化钠溶于水中:S2- H2O=HS- OH-
16.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A K+一定存在 B 100mL溶液中含0.01mol CO32-
C Cl-一定存在 D Ba2+一定不存在,Mg2+可能存在
17、下列各组溶液,不用其他试剂就不能鉴别的是
A.FeCl3、NaNO3、Na2CO3、NaCl B.NaOH、MgSO4、Na2CO3、NaHSO4
C.AgNO3、KNO3、KCl、NaI D.HCl、BaCl2、NaOH、CuSO4
18、有一混合溶液,其中只含有Fe2 、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2 的物质的量之比为(还原性I->Fe2 >Br->Cl-)
A、7∶1 B、7∶2 C、7∶3 D、7∶4
|
建湖县第二中学 2008届高三 年级 班 姓名 学号 座位号 装 订 线 |
 请将选择题的答案填入下表
请将选择题的答案填入下表
一、选择题(每题只有1个正确答案,每小题3分,共30分)
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
二、选择题(每题有1-2个正确答案, 每小题4分,共32分)
|
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
答案 |
|
|
|
|
|
|
|
|
三、填空题
 19.(9分)(Ⅰ)右图为实验室制H2的装置。若液面刚好不与锌粒接触而又无
19.(9分)(Ⅰ)右图为实验室制H2的装置。若液面刚好不与锌粒接触而又无
酸液可加入,则可以从长颈漏斗中加入适量试剂是
①食盐水 ②苯
③四氯化碳 ④Na2CO3溶液
⑤硫酸铜溶液 ⑥KNO3溶液
(Ⅱ)用装置A、B和乳胶管组成装置,用于收集已经干燥的NH3气体(①装置A已经过了气密性检查;②可供选用的试剂有碱石灰、水和酚酞)。
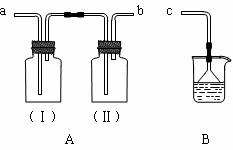
回答下列问题:
⑴干燥剂碱石灰应放在________中(填广口瓶代号)。
⑵NH3气体进入B中出现的现象是___________________________________。
⑶若将上述可供选用的试剂改成浓硫酸和石蕊溶液,仍用装置A、B和乳胶管组成装置,
还可收集其它气体,请列举可收集的气体两种___________________。
(Ⅲ) 粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
⑴蒸发操作中使用到的瓷质仪器的名称为____________________。
⑵该同学将所得精盐配成溶液,用于另一实验。实验中需要用80mL,1mol/L的NaCl溶液,配制过程中用托盘天平称取的精盐质量为_________,用于定容的仪器是__________________。
20.(10分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
阳离子
Na Mg2+ Al3+ Ba2
阴离子
OH– Cl– CO32– SO42– HSO4–
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是
A:__________;B:__________;C:__________;D:__________;E:__________。
21.(8分)某校同学为探究Br2、I2和Fe3 的氧化性强弱,进行了如下实验。
实验①取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl4, 振荡后静置,观察到下层液体呈紫红色;
②取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。
(1)写出实验②中发生氧化还原反应的离子方程式__________________________ ;
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是(填序号)_________ ;
A.Br2>I2 B.Fe3 >Br2 C.Br2>Fe3 D.I->Br-
(3)已知Fe3 的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证实。
①FeCl ![]() 溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉液
溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉液
(友情提示:请写出实验步骤、现象及结论)________________________________ _
_______________________________________________________________________ _
。
22、(7分)位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式 , , , 。
(2)C与D形成D的最低价化合物的电子式:______
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因:______ 。
座位号
23、(12分)(1)已知下列反应在一定条件下可以发生:
H2O2 2Fe2 2H 2Fe3 2H2O H2O2 2Fe3 2Fe2 O2↑ 2H
在以上反应中Fe2 实际上起着 作用,总反应为 。
(2)I2与Fe2 一样也能发生上述类似反应,类比(1)写出合适的化学反应方程式:
H2O2 I2 2HIO, ,总反应为 。
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,
并可以使淀粉溶液变蓝。有学生认为该反应的离子方程式为:H2O2 2I- I2 O2↑ 2H ,
这个方程式正确吗? 。若正确,理由是(若认为不正确,该步不必作答) 。若不正确,写出正确的化学反应方程式(若是离子反应,写出离子反应方程式,没有离子反应的,写出化学反应方程式):
。
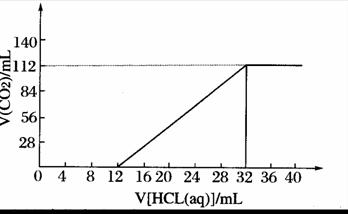
24.现有某种碱金属的两种碳酸盐(正盐和酸式盐)组成的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中逐滴加入一定浓度的稀盐酸,并同时记录放出C02的体积(标准状况) 和消耗稀盐酸的体积,得到如下图所示的曲线。试计算:
(1)原混合物中碳元素的质量分数 。
(2)原混合物中两种盐的物质的量之比 。
(3)所滴加盐酸的物质的量浓度 。
(4)确定此两种盐的化学式 。
08届高三第一次阶段考试
化学参考答案
一、选择题(每题只有1个正确答案,每小题3分,共30分)
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
A |
A |
D |
C |
C |
B |
A |
D |
D |
C |
二、选择题(每题有1-2个正确答案, 每小题4分,共32分)
|
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
答案 |
CD |
AC |
B |
AB |
C |
A |
A |
C |
三、填空题
19.(Ⅰ)①③⑤
(Ⅱ)(1)I (2)B中溶液变红、液面上下波动(只答B中溶液变红也可给 分) (3)HCl、SO2、NO2等
(Ⅲ)(1)蒸发皿 (2)5.9或5.8 100mL 容量瓶
20.Na2CO3 Al2 (SO4) 3 MgCl2 Ba (OH)2 NaHSO4
21.(1)2F3 +Br2 = 2Fe3 +2Br-
(2)A、C
(3)取少量FeCl3溶液于试管中,依次加入KI溶液和淀粉液,振荡,淀粉液变蓝,证实Fe3 氧化性强于I2。
|
2– |
|
Na S Na |
(2)
![]() (3) SO32- H2O HSO3- OH-
(3) SO32- H2O HSO3- OH-
|
|
(3)不正确 H2O2 2I- 2H 2H2O I2,2H2O2 2H2O O2↑
24、(1)9.77% (2)3:2 (3)0.25mol/L (4)K2CO3 、KHCO3
