化 学 试 卷
考生须知:
1.本卷满分100分,考试时间100分钟。
2.答题前,在答题卷密封区内填写学校、班级、姓名和考号。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,只需上交答题卷。
范围:中学化学 时间:2007-12-8
可能用到的相对原子质量:C:12 O:16 H:1 Fe:56 Na:23 S:32 Cl:35.5 Si:28 Cu:64 K:39 Mn:55 Ti:49
第Ⅰ卷 选择题(共52分)
一选择题(每小题2分,本题共22分。每小题只有一个选项符合题意)
1.2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期
A.钅仑 第七周期 B.镭 第七周期 C.铼 第六周期 D.氡 第六周期
2.我国科学家在世界上首次发现铂的一种新同位素 ![]() Pt,下列说法正确的是
Pt,下列说法正确的是
A. ![]() Pt的质量数为202 B.
Pt的质量数为202 B. ![]() Pt的原子质量为202
Pt的原子质量为202
C.铂元素的质量数为202 D. ![]() Pt的原子核内有78个中子、
Pt的原子核内有78个中子、
3.阿伏加德罗常数约为6.02×1023 mol-1,下列说法不正确的是
A.2 mol SO2和1 mol O2混合在(V2O5存在的条件下)密闭容器中加热反应后,容器内物质的分子数大于2NA
B.6.2g白磷P4中所含的P-P键的个数为0.3 NA
C.在标准状况下,V L CH2O中含有的氧原子个数为 ![]()
D.1L 0.5 mol/L CH3COONa溶液中含有的CH3COO-个数为0.5 NA
4.请你运用所学的化学知识判定,下列有关化学观念的叙述错误的是
A 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C 一定条件下,金属钠可以成为绝缘体
D 一定条件下,水在20℃时能凝固成固体
5.正确把握化学用语和化学基本概念是学好化学的基础。下列表述中正确的是
A.物质熔沸点的高低顺序是:氯化钠>晶体硅>冰>氖气
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.P4、CH4、NH4+粒子的空间构型均为正四面体型;CO2、C2H2均为直线型分子
D.Ca2+的结构示意图为 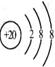 ,NH4Cl的电子式为
,NH4Cl的电子式为 
6.下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
7.下列有关化学键与晶体结构说法正确的是
A 两种元素组成的分子中一定只有极性键
B 离子化合物的熔点一定比共价化合物的高
C 非金属元素组成的化合物一定是共价化合物
D 含有阴离子的化合物一定含有阳离子
8.下列说法正确的是
A.原子晶体中只存在非极性共价键 B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
|
CuSO4 |
|
A.制取CuSO4:Cu |
|
浓H2SO4、△ |
|
Al(OH)3 |
|
C.制取Al(OH)3:Al |
|
NaOH H2SO4 |
|
Na2CO3 |
|
O2 CO2 |
|
D.制取Na2CO3:Na |
|
Cu(NO3)2 |
|
B.制取Cu(NO3)2:Cu |
|
O2、△ |
|
HNO3 |
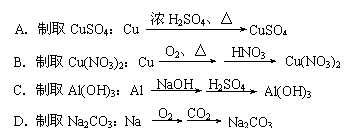 9.下列实验室制取物质的思路既合理又符合绿色化学思想的是
9.下列实验室制取物质的思路既合理又符合绿色化学思想的是
10.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为W<X<Y<Z
D.Y、Z两元素的简单离子的半径Y>Z
11.在含有 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 的溶液中,加入足量的
的溶液中,加入足量的 ![]() 固体并加热,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是
固体并加热,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
二.选择题(每小题3分,本题共30分。每小题只有一个选项符合题意)
12.金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2 + bCl2 + cC ![]() aTiCl4 + cCO ……反应①TiCl4 +2Mg
aTiCl4 + cCO ……反应①TiCl4 +2Mg ![]() Ti + 2MgCl2 ……反应②
Ti + 2MgCl2 ……反应②
关于反应①、②的分析不正确的是
(1) TiCl4在反应①中是还原产物,在反应②中是氧化剂;(2) C、Mg在反应中均为还原剂,被还原;(3)在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4;(4) a=1,b=c=2;(5) 每生成19.6 g Ti,反应①、②中共转移4.8 mol e-。
A.(1)(2)(4) B.(2)(3)(4) C.(3)(4) D.(2)(5)
13.下列有关说法不正确的是
A.石墨晶体是层状结构,在每一层内,每一个碳原于都跟其他3个碳原子相结合,图1是其晶体结构的俯视图
B.CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C.H原子的电子云图如图3所示,H原子核外大多数电子在原子核四周运动
D.比较Na2CO3、NaHCO3的热稳定性可用如图4所示装置,
|
图1 图2 图3 图4 |
|
F- |
|
Ca2+ |
|
澄 清 石灰水 |
|
Na2CO3 |
|
NaHCO3 |
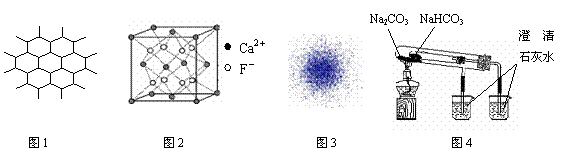 |
14.分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
① 根据酸电离产生H离子的个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④ 根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤ 根据反应的热效应将化学反应分为放热反应和吸热反应
A.②③ B.①②⑤ C.①②④ D.②③④⑤
15、氯气是一种重要的工业原料。工业上利用反应在3Cl2 2NH3 = N2 6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟; B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应; D、生成1molN2有6mol电子转移
16、已知:H2S O2(不足)→S H2O, H2S O2(足量)→SO2 H2O,24ml H2S在30 ml O2中燃烧,同温同压下,得到SO2体积为
A.24ml B.30ml
C.20ml D.18ml
![]() 17.未完成的离子方程式为: XO3- 6H = 3X2 3H2O,据此判定:X元素的最高化合价为
17.未完成的离子方程式为: XO3- 6H = 3X2 3H2O,据此判定:X元素的最高化合价为
A. 7 B. 5 C. 4 D. 1
18. 某氧化物不溶于水,溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是
A.Al2O3 B.MgO C.SiO2 D.P2O5
19.下列关于粒子结构的描述不正确的是
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CH2C12和CCl4均是四面体构型的非极性分子
D.1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值)
20.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A X的氢化物溶于水显酸性
B Y的氧化物是离子化合物
C Z的氢化物的水溶液在空气中存放不易变质
D X和Z的最高价氧化物对应的水化物都是弱酸
21. a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4 的物质的量之比为
A.1 :7 B.7 :1 C.7 :8 D.8 :7
第Ⅱ卷 非选择题(共48分)
22.2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。他的方法不仅被用于学术研究而且被用于化学工业研发。下面选项与物质的表面特性无关的是( )
A.CO在铂表面被氧化生成CO2,铂起催化作用 B、合成氨用铁粉做催化剂
C.汽车尾气中NOx在铂表面发生反应的产物是N2 D、用明矾来净水
E.CO在铂表面可能和O2、NOx反应 F.NOx、CO均能与人体中的血红蛋白结合 G、用还原铁粉和石棉绒混合物与水蒸气制得Fe3O4和H2
H、配制FeCl3 溶液时将FeCl3固体溶于浓盐酸中再加水稀释
23.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子八种微粒(离子或分子)。请回答:
⑴A元素是 、B元素是 、C元素是 (用元素符号表示)。
⑵D是由两种元素组成的双原子分子,其分子式是 。
⑶E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。
⑷F是由两种元素组成的三原子分子,其分子式是 ,电子式是 。
⑸G分子中含有4个原子,其分子式是 。
⑹H分子中含有8个原子,其分子式是 。
24、某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到
 氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
(1)氯气可以用于漂白、消毒的原因是因为能与水
作用形成具有 性的次氯酸,相关反应的离子方程式为 ;
(2)在调查某室外游泳池夏季池水消毒情况时,小
组成员了解到,该游泳池每周一上午8∶00换水,然
后通入氯气消毒,通常游泳池水的含氯量控制在
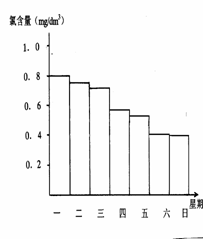
0.5mg/L至1.0mg/L之间时,效果最好。右图是该小
组测定的天天19∶00时泳池中水的氯含量,有哪几
天使用泳池不安全 ;
(3)你认为哪几天的天气炎热、阳光强烈 ,说出一种理由是
;
(4)在对泳池水中通入氯气消毒时,当发生氯气泄漏时,应立即关闭氯气罐,还应采取下列自救方法 。(选填序号)
A、用湿润的毛巾捂住口鼻跑向低处
B、用浸湿小苏打或肥皂水的毛巾捂住口鼻跑向高处
C、用浸湿浓氨水的毛巾捂住口鼻匍匐跑至安全处
D、用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处
(5)小型泳池通常使用漂白液(NaClO溶液)而非氯气来消毒池水,试举出使
用漂白液而非氯气的一项理由 ;
(6)请再写出你能知道的能用于饮用水消毒的消毒剂 .(至少写三种,否则不得分) 请在你书写的药品中选择一种你认为最好的带上飞机,并说明它的原因。选择 原因是 。
(7)较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。该校甲、乙两化学研究性学习小组均用200 mL 12 mol / L盐酸与17.4 g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀氢氧化钠溶液吸收残余的氯气。分析实验结果发现:① 甲、乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值,② 甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。试回答下列问题:
a. 上述实验中理论上最多可制得Ca(ClO)2 克?
b. 实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。(至少说出一种理由,写出一个方程式)
25. U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴.V的单质分子的结构式为_______________;XW的电子式为____________;
Z元素在周期表中的位置是_____________。
⑵.U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证实____________________________________________________。
⑷.YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
08届高三化学第一学期第三次月考试题
化学试卷答案
1. A 2.A 3.D 4.B 5.C 6.B 7.D 8.B 9.B 10.A 11.C
12.D 13.C 14.B 15.C 16.D. 17.A 18.C 19.C 20.B 21.B
22.F.H
23. ⑴K Cl S
⑵HCl
⑶F2
⑷H2S HSH
⑸H2O2(答PH3同样给分)
⑹C2H6
24
(1)强氧化 (1分); Cl2 H2O ![]() H Cl- HClO (2分)
H Cl- HClO (2分)
(2)星期六、星期日 (1分)
(3)星期四、星期六 (1分); 阳光强烈HClO更易分解,致含氯量下降明显 (1分)
(4)B (2分)
(5)NaClO更稳定,便于储存和运输(1分);
(6)氯水、漂白粉、二氧化氯、双氧水、过氧乙酸、臭氧及高铁酸钠等(2分) 选择 漂白粉、(高铁酸钠)(1分) 原因:这些物质具有强氧化性,具有杀菌消毒作用,比其他药品易于存放运输,且安全(1分)
(7) (a)根据题意,n(HCl)=12 mol / L×0.2 L=2.4 mol
n(MnO2)= ![]() =0.2 mol
=0.2 mol
MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
n(HCl)︰n(MnO2)=2.4︰0.2=12︰1>4︰1
所以浓盐酸过量,应根据MnO2计算。
根据制备氯气的化学方程式
n(Cl2)=n(MnO2)=0.2 mol
又因为2Cl2+2Ca(OH)2=CaCl2 +Ca(ClO)2+2H2O
n[Ca(ClO)2]= ![]() n(Cl2)=0.1 mol
n(Cl2)=0.1 mol
m[Ca(ClO)2]=143 g / mol×0.1 mol=14.3 g
(b)① 随着反应进行,温度升高,会产生副产物Ca(ClO3)2
6Cl2+6Ca(OH)2 ![]() 5CaCl2 +Ca(ClO3)2+6H2O
5CaCl2 +Ca(ClO3)2+6H2O
② Cl2未与石灰乳完全反应,残余氯气被NaOH溶液吸收,
Cl2+2NaOH=NaCl+NaClO+H2O
25. ⑴.N≡N (1分)
⑵. ![]() (1分)
(1分)
第4周期,第VIII族 (2分)
⑵.① ③ (2分)
⑶.CH4 NH3 (各1分,共2分)
NH3 H3O+ ==== NH ![]() * MERGEFORMAT H2O (2分)
* MERGEFORMAT H2O (2分)
⑷.3SO2 2NO ![]() * MERGEFORMAT 3Ba2+ 2H2O ==== 3BaSO4 ↓ 2NO 4H+ (2分)
* MERGEFORMAT 3Ba2+ 2H2O ==== 3BaSO4 ↓ 2NO 4H+ (2分)
SO2 (1分)
