|
第I卷(选择题,共48分)
一、选择题(共8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是
A.盐酸、水煤气、醋酸、干冰 B.冰醋酸、福尔马林、硫酸钠、乙醇
C.胆矾、漂白粉、氯化钾、氯气 D.王水、混甘油酯、苛性钾、石灰石
2.将纯水加热至80℃,下列叙述正确的是:
A.水的离子积不变 B.水的pH变小,呈酸性
C.水的pH变大,呈中性 D.水中c(H )==c(OH—)>1×10—7mol/L
3.下列实验中金属或氧化物可以完全溶解的是
A.1 mol锌片与含1 mol HCl的稀溶液混合
B.1 mol MnO2粉末与含4 mol HCl的浓盐酸共热
C.常温下1 mol铝片投入足量的浓硫酸中
D.常温下1 mol铜片投人含4 mol HNO3的浓硝酸中
4.下列对实验仪器名称的标注或实验操作,正确的是

5.下列各项操作中,不发生“先产生沉淀后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量的CO2 ② 向Fe(OH)3胶体中逐滴滴加入过量的稀硫酸
③向氨水中逐滴加入AgNO3溶液至过量 ④向石灰水中通入过量的CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸
A.①②③⑤ B.①③⑤ C.①⑤ D.②③⑤
6.下列有关热化学方程式的叙述中,正确的是
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出 28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(l) △H=十57.4 kl/mol
B.已知C(石墨,s)=C(金刚石,s) △H> 0,则金刚石比石墨稳定
C.已知2H2(g)十O2(g)=2H2O(g) △H=-483 6 kJ/mol,则H2的燃烧热为 241.8kl/mol
 D.已知 D.已知
则△H1<△H2
7. a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4 的物质的量之比为
A.1 :7 B.7 :1 C.7 :8 D.8 :7
8.已知: = 1 \* GB3 ①向KMnO4晶体滴加浓盐酸,产生黄绿色气体, = 2 \* GB3 ②向FeCl2溶液中通人实验 = 1 \* GB3 ①产生的气体,溶液变黄色; = 3 \* GB3 ③取实验 = 2 \* GB3 ②生成的溶液滴在淀粉KI试纸上,试纸变蓝色
下列判定不正确的是:
A.上述实验证实氧化性:MnO4- >Cl2 >Fe3 >I2
B.上述实验中的三个主要反应都是氧化还原反应
C.实验 = 2 \* GB3 ②证实Fe2 既有氧化性又有还原性
D.实验 = 1 \* GB3 ①产生的气体同样能使湿润的淀粉KI试纸变蓝色
二、选择题(共8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。)
9.阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是
A.16.9 g BaO2固体中阴、阳离子总数约为0.3×6.02×1023
B.2.3 g 钠被O2完全氧化时,失去电子数约为0.1×6.02×1023
C.0.5 mol超重水(T2O)的质子总数约为5×6.02×1023
D.常温下,11.2 L甲烷与乙烯的混合物所含氢原子的数目约为2×6.02×1023
10.一定能在下列溶液中大量共存的离子组是
A.使紫色石蕊试液变蓝的溶液:Na+ AlO2- S2ˉ SO42ˉ
B.pH=0的溶液:Zn2+ NO3- Cl- I-
C.由水电离的c(H )=10ˉ14 mol/ L-l的溶液中:Ba2+ K Na+ HCO3-
D.含有大量Al3+的溶液:H+ Cu2+ Mg2 SO42-
11.下列离子方程式书写正确的是
A.在澄清的石灰水中通入过量的CO2:CO2 OH- HCO 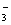
B.NaHS溶液呈碱性:HS— H2O SHAPE \* MERGEFORMAT 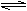  H3O S2— H3O S2—
C.4 mol/L的KAl(SO4)2溶液与7 mol/L的Ba(OH)2溶液等体积混合:
4Al3 7SO42— 7Ba2 14OH—==2Al(OH)3↓ 2AlO2— 7BaSO4↓ 4H2O
D.将过量的SO2气体通入Ca(ClO)2溶液中:SO2 ClO— H2O==HClO HSO3—
 12.在一定条件下,固定容积的密闭容器中反应:2NO2(g) 12.在一定条件下,固定容积的密闭容器中反应:2NO2(g) 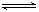 O2(g)+2NO(g);DH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是 O2(g)+2NO(g);DH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
A. 当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C. 当X表示反应时间时,Y表示混合气体的密度
D. 当X表示NO2的物质的量,Y表示O2的物质的量
13.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极四周溶液的pH升高
C.阳极反应方程式为:2Cl--2e-=Cl2
D.1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子。
14.下列各溶液中,微粒的物质的量浓度关系不正确的是:
A. 10mL 0.5mol/L CH3COONa溶液和6mL 1mol/L盐酸混合:c(Cl-)>c(Na )>
c(H )>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
C.在NaHA溶液中一定有:c(Na ) c(H )=c(HA-) c(OH-) c(A2-)
D. c(NH4 )相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
15. 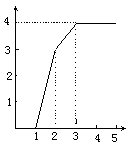 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2 的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如右图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2 的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如右图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1∶1∶4 B.1∶3∶1
C.3∶3∶8 D.1∶1∶1
16.a mol FeS与b mol FeO投入到V L、c mol•L-1的硝酸中恰好反应,产生NO气体,所得澄清溶液是Fe(NO3)3、H2SO4的混合液,反应中被还原的硝酸可能为
A.(a b)×63g B.(a b)mol C.( 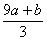 )mol D.(V×c-3a-3b)×63g )mol D.(V×c-3a-3b)×63g
第Ⅱ卷(非选择题 共72分)
三.(本题包括2小题,共22分)
17.(8分)文献资料显示,草木灰主要含有不溶性杂质及K2CO3,还含有少量KCl、K2SO4等。
某化学爱好小组拟测定草木灰中钾盐的含量及钾盐中K2CO3的含量。
【测定草木灰中钾盐含量】
⑴该实验的主要步骤顺序为:称量.→ → → → →冷却→再称量(填字母序号)
A. 溶解 B.过滤 C、洗涤、烘干 D、蒸发
⑵称量前,在调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向 (填左、右)旋动。某学生称量时,在天平右盘加上规定质量的砝码后,在左盘的小烧杯中加入样品,此时指针稍偏右边,该学生的操作应为 。
⑶实验中A、B、C、D三步操作均使用了玻璃棒,操作B中玻璃棒的作用是 ,操作D用玻璃棒不断搅动的原因 。
【测定钾盐中K2CO3含量】
⑷取上述操作中所得的钾盐,配成稀溶液,加入CaCl2溶液使CO32-生成沉淀,过滤得到碳酸钙沉淀后,用蒸馏水多次洗涤,烘干、称量、计算。检验沉淀是否完全的方法是 ,检验沉淀是否洗净的方法是
18.(14分)硫酸铜是一种应用极其广泛的化工原料。制备硫酸铜是无机化学实验教学中一个重要的实验。由于铜不能与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
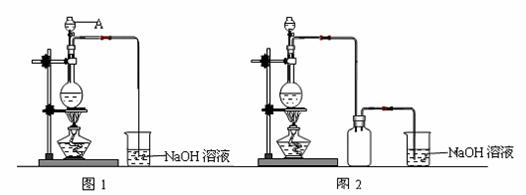
(1)图1中,A仪器的名称为 ,烧瓶中发生的离子反应方程式为 。
(2)图2是图1的改进装置,改进的目的是 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,反应完全后,向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。a、CaO b、CuCO3 c、CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol/L的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6g。请回答下列问题:
③该反应的离子反应方程式为 。
④控制温度在50℃和60℃加热的原因为 ,晶体采用酒精淋洗的优点是 。
⑤上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是 。
四.(本题包括3小题,共30分)
19.(10)一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
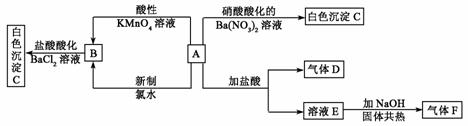
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)写出下列物质化学式:
A:_________________;C:_________________;
(2)写出下列反应的离子方程式:
①A和酸性KMnO4溶液:________________。②A和新制氯水:_____________________。
(3)通过本题的解答在检验SO 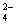 时是使用HCl酸化的BaCl2溶液还是使用硝酸酸化的Ba(NO3)2,你得到的启示是:__________________________________________________。 时是使用HCl酸化的BaCl2溶液还是使用硝酸酸化的Ba(NO3)2,你得到的启示是:__________________________________________________。
20.(8分)(1)某温度下,密闭容器中,发生如下可逆反应:2E(g)  F(g)+x G(g);ΔH<0。若起始时E浓度为a mol·L-1 ,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1 ;若E的起始浓度改为2a mol·L-1 ,F、G浓度仍为0。当达到新的平衡时, = 1 \* GB3 ①若x=l,容器体积保持不变,新平衡下E的体积分数为 ; = 2 \* GB3 ② 若x=2,容器体积保持不变,新平衡下F的平衡浓度 0.5a mol·L-1 (填 “>” “<” “=”)。 F(g)+x G(g);ΔH<0。若起始时E浓度为a mol·L-1 ,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1 ;若E的起始浓度改为2a mol·L-1 ,F、G浓度仍为0。当达到新的平衡时, = 1 \* GB3 ①若x=l,容器体积保持不变,新平衡下E的体积分数为 ; = 2 \* GB3 ② 若x=2,容器体积保持不变,新平衡下F的平衡浓度 0.5a mol·L-1 (填 “>” “<” “=”)。
(2)t℃ 将3 mol A气体和1 mol B气体通入2 L固定体积的密闭容器中,发生如下反应:3A(g) B(g)  X C(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4 mol·L-1;请填写下面空白: X C(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4 mol·L-1;请填写下面空白:
= 1 \* GB3 ① 从开始反应至达到平衡状态,生成C的平均反应速率为 ,X= ;
= 2 \* GB3 ② 若继续向原平衡混合物中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡
将 移动;
= 3 \* GB3 ③若向原平衡混合物的容器中再充入amolC,在t℃达到新的平衡,此时B的物质的量为:
n(B)= mol;
= 4 \* GB3 ④假如上述反应在相同温度和容器中进行,欲使反应达到平衡时物质的量分数与原平衡时相同,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系为 。
21.(12分)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2 、Pb(OH) 、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
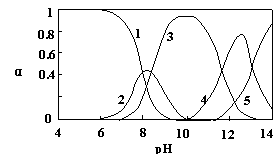
【1表示Pb2 ,2表示Pb(OH) ,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-】
⑴Pb(NO3)2溶液中, 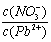 2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后, 2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后, 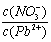 增加,可能的原因是 。 增加,可能的原因是 。
⑵往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子(Na 除外)有
,pH=9时,主要反应的离子方程式为 。
⑶某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
 离子 Pb2 Ca2 Fe3 Mn2 Cl- 离子 Pb2 Ca2 Fe3 Mn2 Cl-
处理前浓度/(mg·L-1) 0.100 29.8 0.120 0.087 51.9
处理后浓度/(mg·L-1) 0.004 22.6 0.040 0.053 49.8
 上表中除Pb2 外,该脱铅剂对其它离子的去除效果最好的是 。 上表中除Pb2 外,该脱铅剂对其它离子的去除效果最好的是 。
⑷假如该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s) Pb2  E2Pb(s) 2H E2Pb(s) 2H
则脱铅的最合适pH范围为 (填代号)。
A.4~5 B.6~7 C.9~10 D.11~12
五、(本题包括2小题,共20分)
22.(8分)白色粉末A由Na2S、Na2SO3、Na2SO4和NaCl等物质中的三种混合而成。取一定量A样品,投入100 mL 2.2 mol·L-1 盐酸中,充分反应后过滤,最终得到100 mL含H 的物质的量浓度为1 mol·L-1的滤液,若将此滤液蒸干,只得到8.19 g纯净物B。
(1)A中是否有NaCl__________(填“有”或“没有”),理由是______________________
___________________________________。
(2)若反应后还生成0.896 L(标准状况)气体,且该气体不会使品红褪色。求所取的A样品中含有Na2S的物质的量。(已知2S 2-+SO32-+6H =3S↓+3H2O)
23.(12分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_________________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。正极反应_________________________,负极反应____________________________________。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤_______________________________________________。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH | |
Fe3+ |
1.9 |
3.2 | |
Fe2+ |
7.0 |
9.0 | |
Cu2+ |
4.7 |
6.7 | |
提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu | | 
 ;
;