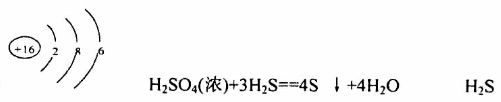| |
|
[组图]高三化学无机框图题专项训练
|
| 查询化高三上末的详细结果
|
|
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至4页,第Ⅱ卷5至8页。考试结束后,将第Ⅱ卷和答题卡一并交回。
注重事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考试号、考试科目涂写在答题卡上。
2.每题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号,不能答在试题上。
可能用到的相对原子质量:H:1 C:12 O:16 Ca:40 Fe:56
第Ⅰ卷(选择题 共50分)
一、选择题(本题包括20小题,1-10题每题2分,11-20题每题3分,共50分。每小题只有一个选项符合题意)
1.下列表述正确的是
①现代研制的油漆中一般不使用甲醛、酚类等化合物,因为这些化合物对人体有毒②我国从2000年起逐渐用二氧化氯取代氯气对饮用水进行消毒,因为二氧化氯杀菌、消毒能力强,持效长③我国禁止汽车使用含铅汽油,其主要原因铅资源短缺④明矾能使水中的悬乳物凝聚,可做为净水剂⑤赤潮、白色污染、绿色食品都与相关物质颜色有关⑥给机动车安装尾气净化器,可减少光化学烟雾的发生⑦开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生
A.①③④⑤⑥ B.①②④⑥⑦ C.②③④⑤⑥ D.全部
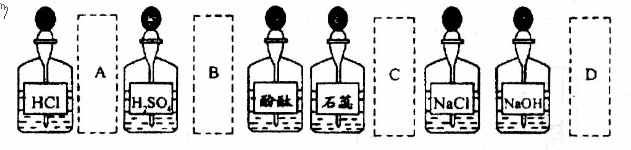
2.实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用Ba(OH)2溶液后,应把它放回的位置是
3.艾滋病问题备受世人关注。最近医学家们通过用放射性14C标记C60,发现C60的一种羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病病毒。下述正确的是
A.艾滋病病毒的成分为多糖 B.放射性14C与12C所含的中子数相同
C.放射性14C是C60的同素异形体 D.放射性14C与12C属于同位素
4.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习方法之一,下列对有关实验事实的解释正确的是
A.溴水中通入乙烯后,颜色褪去,说明乙烯表现了漂白性
B.FeCl3溶液中加入铜粉,不能发生反应,因为铜的金属性弱
C.将锌片加入到相同浓度的Cu(NO3)2和AgNO3混合溶液中,首先析出的是Ag,说明Ag 的氧化性比Cu2 强
D.常温下,将铝片放入浓硫酸中无明显现象,说明铝不和冷的浓硫酸反应
5.右边的标签,是同学们经常使用的一种修正液的包装说明。某同学在仔细阅读后,结合自己的生活经验和所学知识,得出了修正液的某些性质的推测,请你分析他的结论中合理的是

A.纸张的成分是纤维素,修正液对其具有腐蚀性
B.修正液是一种胶体,均一、透明
C.修正液中不仅含有易挥发的有机物质、也含有毒的物质
D.修正液的溶剂不易燃烧,可以接触明火
6.下列各实验装置图的叙述中,正确的是
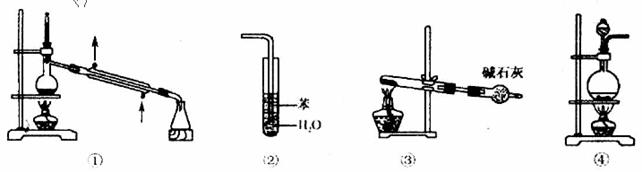
A.装置①可用于石油的分馏实验 B.装置②可用于吸收HCl气体,并防止倒吸
C.装置③可于以NH4Cl一种药品为原粒制取NH3 D.装置④可用于实验室制取乙烯
7.2008奥运会吉详物福娃,其外材为纯羊毛线,内充物为无毒的聚纤维(结构简式如下图)。
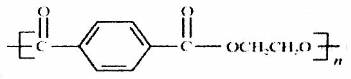
下列说法中,不正确的是
A.羊毛与聚酯纤维的化学成分不相同 B.聚酯纤维和羊毛都属于天然高分子材料
C.该聚酯纤维的单体为对苯二甲酸和乙二醇D.聚酯纤维和羊毛在一定条件下均能水解
8.下列表述正确的是
A.甲烷、苯、乙醇和乙酸都能发生加成反应
B.欲将蛋白质从水中析出而双不改变它的性质,应加入CuSO4溶液
C.PP塑料(聚丙烯)结构简式 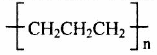
D.丁烷催化裂解可按两种方式进行:
C4H10→C2H4 C2H6; C4H10→CH4 C3H6
9.一定温度下,向饱和NaOH溶液中投入一小块金属钠,充分反应后恢复到原来温度。下列叙述中,不合理的是
A.NaOH溶液浓度增大,并入出H2 B.溶液中NaOH的质量分数不变,有H2放出
C.总溶液的质量减小,有H2放出 D.钠浮于液面,到处游动,发出咝咝的响声
10.下列各组顺序不正确的是
A.粒子半径:S2->S Na>Na
B.热稳定性:SiH4<PH3<NH3<H2O<HF
C.氧化性:F2>Cl2>Br2>I2>O2
D.还原性:HF<HCl<HBr<HI<H2S
11.用NA表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,22.4LSO3所含的分子数约为NA
B.92g四氧化二氮和二氧化氢和混合物中含有的原子总数一定为6NA
C.56g铁粉与硝酸反应失去的电子数一定为3NA
 D.有1molCH3COO-的醋酸钠溶液中,Na 数目等于NA D.有1molCH3COO-的醋酸钠溶液中,Na 数目等于NA
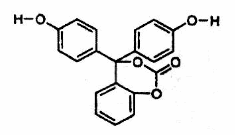
12.如图为某有机物的结构简式。已知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:
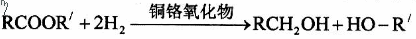
关于该化合物的下列说法中,不正确的是
A.该有机物的化学式为C20H14O5
B.该有机物可以与浓溴水反应
C.与足量氢氧化钠溶液充分反应,所得产物中有醇类物质
D.1mol该有机物在铜铬氧化物催化下仅能与2mol氢气发生反应
13.X、Y、Z为三种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y在地壳中的含量仅次于X;Y、Z同周期,Z的常见化合价为 2。下列说法不正确的是
A.X、Y、Z的原子序数依次增大
B.X与Z形成的化合物为离子化合物
C.X与Y形成的化合物只含共价键
D.存放Z单质的仓库失火不能用CO2灭火
14.下列离子方程式书写不正确的是
A.将Ca(HCO3)2溶液与NaOH溶液以溶质的物质的量之比1:1混合;
OH- Ca2 HCO3-=CaCO3↓ H2O
B.用足量氨水吸收少量的SO2:NH3·H2O SO2=NH4 HSO3-
C.过氧化钠投入重水中:2Na2O2 2D2O=4Na O2↑ 4OD-
D.苯酚钠溶液中通入CO2:C6H5O- CO2 H2O→C6H5OH HCO3-
15.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是
A.Fe3 、Na 、Cl-、S2-(1:2:3:1) B.NH4 、Ba2 、OH-、NO3-(1:1:1:2)
C.K 、H 、I-、HCO3-(1:1:1:1) D.Na 、Al3 、Cl-、OH-(4:1:4:3)
16.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4 2H2O==NaBO2 4H2↑,下列说法中正确的是(NaBH4中H为-1价)
A.NaBH4既是氧化剂又是还原剂
B.被氧化的元素与被还原的元素质量比为1:4
 C.硼元素被氧化,氢元素被还原 C.硼元素被氧化,氢元素被还原
D.NaBH4是还原剂,H2O是氧化剂
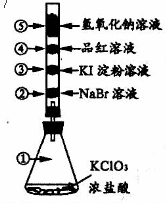
17.已知常温下氯酸钾与浓盐酸反应能放出氯气,现按右下图进行卤素的性质实验。玻璃管内分别装有滴有少量不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
|
|
① |
② |
③ |
④ |
⑤ | |
A |
黄绿色 |
橙色 |
蓝色 |
白色 |
白色 | |
B |
黄绿色 |
橙色 |
蓝色 |
红色 |
白色 | |
C |
黄绿色 |
无色 |
紫色 |
红色 |
黄绿色 | |
D |
无色 |
橙色 |
紫色 |
白色 |
黄绿色 | |
18.近几年一种新型的甜味剂木糖醇静静地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中不正确的是
A.木糖醇与葡萄糖、果糖不一样,它不属于单糖
B.木糖醇不能跟新制的氢氧化铜浊液反应生成红色沉淀
C.木糖醇与乙醇属于同系物
D.木糖醇是一种五元醇,可以与羧酸在一定条件下发生酯化反应
19.有以下六种饱和溶液①CaCl2;②Ca(OH)2;③Na2SiO3;④Na2CO3;⑤Na[Al(OH)4](NaAlO2);⑥NH3和NaCl,分别持续通入CO2,最终不会得到沉淀或析出晶体的是
A.①② B.③⑤ C.①⑥ D.④⑥
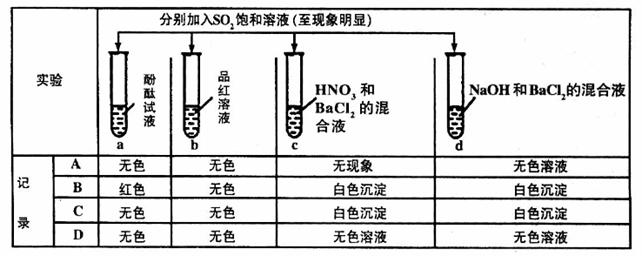
20.下列实验报告记录的实验现象正确的是
第Ⅱ卷(非选择题 共50分)
注重事项:1.Ⅱ卷共4页,用钢笔或圆珠笔直接答在试题卷上。
2.答卷前将密封线内的项目和座号填写清楚。
二、(本题包括3小题,共19分)
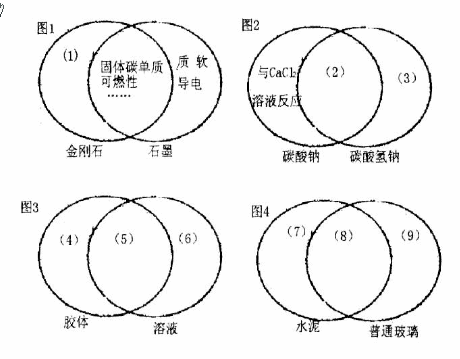
21.(1)下图是一种用于显示事物异同点的信息处理方法。图1中两个圆分别代表金刚石和石墨的有关信息,两圆重叠区域表示金刚石和石墨的共同特点(相似点),重叠区域以外的部分表示它们独有的特征(不同点。)请你在下列的空格内填写适当内容。(每处只要求填一点)
(1)____________________;(3)____________________;
(6)____________________;(7)____________________;
(Ⅱ)随着铁矿的开发,某地建立了如下图所示位置关系的炼焦厂、钢铁厂、发电厂和水泥厂
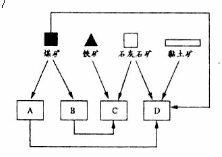
请写出图中B、D所代表的两个工厂的名称:B.__________;D._________。
22.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
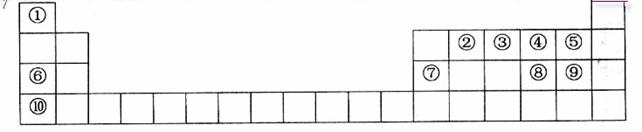 (1)表中最活泼的金属与最活泼的非金属形成的化学式是________________; (1)表中最活泼的金属与最活泼的非金属形成的化学式是________________;
(2)⑧号元素的原子结构示意图为___________,其最高氧化物水化物浓溶液与其氢化物反应的化学工程形式为_____________,该反应中,_____________是还原剂。
(3)________号元素的单质既能与酸反应,又能与碱反应?写出与碱反应的化学方程式。_________________________________________。
(4)猜测⑥、⑦和⑩号元素的金属性,____________最强(填元素符号)。设计实验方案验证。
___。
23.有机物A的结构简式如下图所示:
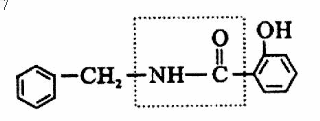
(1)在一定条件下,1molA最多能与________molH2发生加成反应;
(2)在A的结构简式中,虚线框内的结构名称为_____________键;
(3)有机物A在稀硫酸中受热会水解成B和C,其中C具有酸性,则有机物B的结构简式为_________________________
(4)有机物C的同分异构体中属于酚类,同时又属于醛类的化合物有_________种;有机物C的同分异构体中属于本酚类,同时又属于酯类的化合物有____________种。
三、(本题包括2小题,共16分)
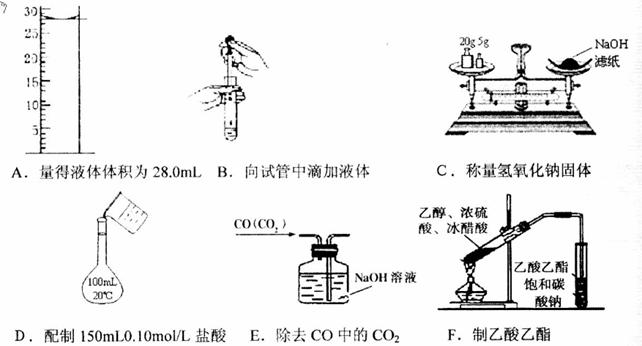
24.(1)下列有关实验操作或判定正确的是___________(填有关序号,选错倒扣分)。
A.用10mL量筒量取稀硫酸溶液8.0mL
B.用干燥的pH试纸测定氯水的pH
C.新制氢氧化铜浊液(与醛反应):在试管中加2mLCuSO4溶液,滴加5%NaOH溶液4~5滴
D.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
F.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
G.配制银氨溶液时,应把硝酸银溶液逐滴加入氨水中
H.用溴水除去乙烯中混有的二氧化硫气体
I.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
(2)下列操作正确的是
25.某化学爱好小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。
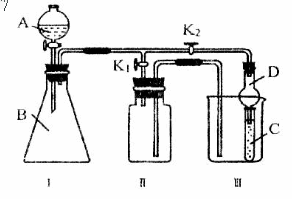
(1)能用Ⅰ装置制取,用Ⅱ装置收集的气体(K2关闭,K1打开)(写出一种即可)_____;有关化学反应方程式为:___________________________。
能用Ⅰ装置制取,不能有Ⅱ装置收集的气体(K2关闭,K1打开)(写出一种即可)
_________;若收集该气体,需对Ⅱ进行怎样的改进?__________________________。
(2)利用Ⅰ、Ⅲ装置验证物质的性质(K2打开,K1关闭)。
已知浓HCl与次氯酸钙能反应:Ca(ClO)2 4HCl(浓)==CaCl2 2Cl2↑ 2H2O。甲同学想证实氧化性:Ca(ClO)2>Cl2>Br2,则在A中加浓盐酸,B中加Ca(ClO)2,C中加__________,观察到C中的现象是_____________________________________;
从环境保护的观点考虑,此装置有何不足?_______________________________________,应怎样改进?_____________________________________________________;
画出实验室中通常进行此操作的装置图:________________________。
乙同学利用此装置制取乙炔气体,将其通入C中验证性质。若C中装有酸性KMnO4溶液,其现象为_________________________;若C中装有溴水,则乙炔与溴水反应的产物为(写结构简式)__________________________________。
四、(本题包括2小题,共15分)
26.现有A、B、C、D、E、F、X、Y、Z和M等物质,它们均为纯净物,在一定条件下发生下列转化:
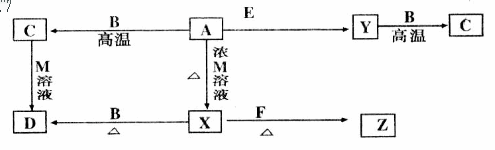
其中:X、Y为常见双原子气体单质(X常温下为有色气体);B为常见金属单质,密度小,导电性较强;F为常见紫红色金属单质;C溶于强酸和强碱;E为两种常见元素(按原子个数1:1)组成的液体;A为黑色化合物。上述各步转化中只写出其中一种生成物,其它生成物没有写出(也有可能反应仅有一种生成物)。
试回答:
(1)写出化学式:D__________,Z__________。
(2)写出A→X的离子方程式和Y→C的化学方程式:
A→X:__________________;Y→C______________________。
27.煤的气化和液化是使煤变成清洁能源的有效途径。煤气化的主要反应是:C H2O(g)——CO H2,CO和H2的混合气体是合成多种有机物的原料气。下图是合成某些物质的路线。其中,D易溶于水,且与CH3COOH互为同分异构体,既能与银氨溶液反应,又能发生酯化反应;F分子中的碳原子数是D的3倍;H经催化氧化可得到G。请回答下列问题:
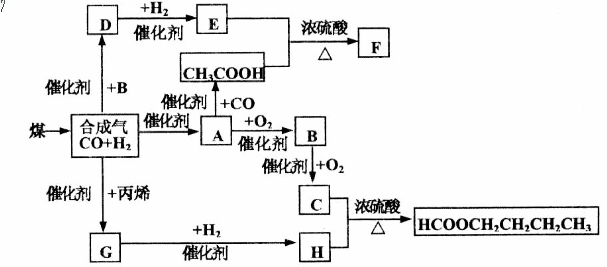
(1)写出下列物质的结构简式:E___________B__________;E与H是否属于同系物:________________(填是或否)。
(2)D的同分异构体除CH3COOH外还有:___________________-;
(3)写出下列反应的化学方程式:
C H_____________________________________________;
D与银氨溶液反应________________________________________。
(4)A为工业常用燃料。某同学将A完全燃烧,产生的二氧化碳气体通入澄清石灰水中。
①产生沉淀的量W随通入二氧化碳(至过量)的体积V而变化,可用图像直观地表达。请在下边画出这一关系图象。
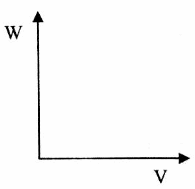
②若该同学实验时共取了200mL0.1mol/L的石灰水,通入一定量的二氧化碳后,得到1g沉淀,那么,他通入的二氧化碳的体积可能为___________________________。
2007年威海市市直高中毕业年级教学质量考试
化学 答案及评分标准
(凡有其它合理的方式和方法,均参照本标准评分)
注重:1、凡元素符号、化学式有错,及化学专用词语出现错别字的,有关内容不得分。
2、各种化学方程式没有配平的,均不得分。
3、答题时,若只答出含义而未答出要点的,有关内容不得分;没有用化学专用词语答题者,有关内容不得分。
一、选择题(本题包括20小题,50分 1-10每小题2分,11-20每小题3分。每小题只有一个选项符合题意)
1B 2D 3D 4C 5C 6A 7B 8D 9A 10C 11B 12D 13A 14B 15B 16D 17A 18C 19A 20C
二、(本题包括3小题,共19分)
21.(6分,每空1分)(有其他合理答案也可酌情得分)
(Ⅰ)质硬,不导电;(3)加热分解;(6)稳定;(7)水硬性;
(Ⅱ)B.炼焦厂 D.水泥厂
22.(8分,每空1分)
(1)KF
(2) 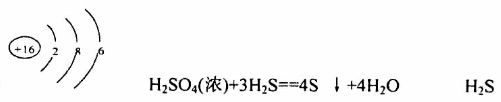
(3)⑦ 2Al 2NaOH 2H2O=2NaAlO2 3H2↑
或2Al 2NaOH 6H2O=2Na[Al(OH)4] 3H2↑
(4)K K与水反应比Na更强烈。(Na与水反应发出嘶嘶的响声,K使生成的氢气燃烧,并发生微爆炸);Na常温与水反应剧烈,Al常温难与水反应。
23.(5分,每空1分)
(1)6
(2)肽
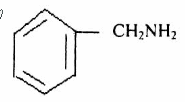
(3) 
(4)6:3;
三、(本题包括2小题,共16分)
24.(5分,除注明外,其余每空1分)
(1)AFI(3分,每个1分,多答倒扣分)
(2)AF (2分,每个1分,多答倒扣分)
25.(11分,每空1分)
(1)H2或C2H2;方程式与气体要对应。H2S、CO2、NO、NO2等;改进方法;NO用排水法,其他要改为导管长进短出。
(2)NaBr溶液; 溶液由无色变成橙色或橙红色;氯气易逸出污染环境;应加NaOH溶液吸收氯气的装置
紫色褪去;CHBr2-CHBr2
四、(本题包括2小题,共15分)
26.(4分,每空1分)
(1)D:AlCl3 Z:CuCl2
(2)MnO2 4H 2Cl-====Mn2 Cl2↑ 2H2O
4Al 3O2====2Al2O3
27.(11分,除注明外,其余每空1分)
(1)HOCH2CH2OH HCHO 否
(2)HCOOCH3
(3) 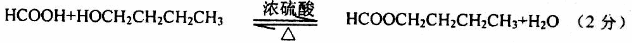
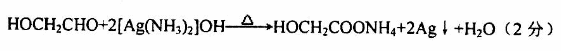
(4)①
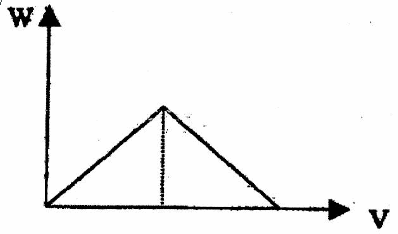
②(2分) 0.224L或0.672L
|



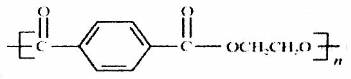
 D.有1molCH3COO-的醋酸钠溶液中,Na 数目等于NA
D.有1molCH3COO-的醋酸钠溶液中,Na 数目等于NA![]()
 C.硼元素被氧化,氢元素被还原
C.硼元素被氧化,氢元素被还原


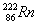


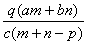




 (1)表中最活泼的金属与最活泼的非金属形成的化学式是________________;
(1)表中最活泼的金属与最活泼的非金属形成的化学式是________________;