专项测试 化学平衡测试题
|
•设计意图• (1)了解化学反应的可逆性,理解化学平衡的含义及其与化学反应速率之间的关系;(2)理解化学平衡的特征和化学平衡状态的标志;(3)能够进行有关等效平衡的判定;(4)理解勒夏特列原理和含义,把握浓度、温度、压强等条件对化学平衡移动的影响。 |
 测试时间:45分钟 本卷总分:100分
测试时间:45分钟 本卷总分:100分
一、选择题(10×4=40分)
1.反应:A(g)+3B(g) ![]() 2C(g)[ΔH<0]达平衡后,将气体混合物的温度降低,下列叙述中正确的是 ( )
2C(g)[ΔH<0]达平衡后,将气体混合物的温度降低,下列叙述中正确的是 ( )
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率变小,平衡向正反应方向移动
D.正反应速率和逆反应速率变小,平衡向逆反应方向移动
2.可逆反应N2 3H2 ![]() 2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是 ( )
2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是 ( )
A.3v正(N2)= v正(H2)
B.v正(N2)= v正(NH3)
C.2v正(H2)=3 v正(NH3)
D.v正(N2)=3 v逆(H2)
3.某温度下,在容积可变的容器中,反应2A(g) B(g) ![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是 ( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是 ( )
A.均减半 B.均加倍
C.均增加1mol D.均减少1mol
4.恒温恒压下,在容积可变的器皿中,反应2NO2(g) ![]() N2O4(g) 达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数 ( )
N2O4(g) 达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数 ( )
A.不变 B.增大 C.减小 D.无法判定
5.在一密闭容器中,反应mA(g) nB(g) ![]() pC(g),达到平时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判定正确的是 ( )
pC(g),达到平时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判定正确的是 ( )
A.化学计量数:m n>p
B.平衡向正反应方向移动了
 C.物质B的转化率减小了
C.物质B的转化率减小了
D.物质C的质量分数增加了
6.在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g) B(g) ![]() 2C(g);ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是 ( )
2C(g);ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是 ( )
X
Y
A
再加入A
B的转化率
B
再加入C
A的体积分数
C
增大压强
A的转化率
D
升高温度
混合气体平均摩尔质量
7.取1molX气体和amolY气体在体积可变的容器中发生如下反应:X(g)+aY(g) ![]() bZ(g) 反应达到平衡是,测得X的转化率为50%。而且,同温、同压下还测得反应前混合气体的密度是反应后混合气体的密度的3/4,则a和b的数值可能是 ( )
bZ(g) 反应达到平衡是,测得X的转化率为50%。而且,同温、同压下还测得反应前混合气体的密度是反应后混合气体的密度的3/4,则a和b的数值可能是 ( )
A.a=1,b=1 B.a=2,b=1
C.a=2,b=2 D.a=3,b=2
8.已知400℃和1.01×105Pa时的气体摩尔体积为55.20L·mol-1,在该条件下有1mol气体X发生如下反应并达到平衡:2X(g) ![]() mY(g) Z(g),测得平衡混合气体中X的体积分数为58.80%,混合气体的总质量为46.00g,混合气体的密度为0.72g·L-1。则平衡混合气体的平均相对分子质量为 ( )
mY(g) Z(g),测得平衡混合气体中X的体积分数为58.80%,混合气体的总质量为46.00g,混合气体的密度为0.72g·L-1。则平衡混合气体的平均相对分子质量为 ( )
A.58.80 B.46.00 C.39.74 D.16.13
9.在n L密闭容器中,使1mol X和2mol Y在一定条件下反应:aX(g)+bY(g) ![]() cZ(g),达到平衡时,Y的转化率为20%,混合气体压强比原来下降20%,Z的浓度为Y的浓度的0.25倍,则a、c的值依次为 ( )
cZ(g),达到平衡时,Y的转化率为20%,混合气体压强比原来下降20%,Z的浓度为Y的浓度的0.25倍,则a、c的值依次为 ( )
A.1、2 B.3、2
C.2、1 D.2、3
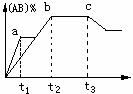 10.反应A2 B2
10.反应A2 B2 ![]() 2AB在不同温度和压强改变的条件下产物AB的生成情况如图所示,a为500℃,b为反应在300℃时情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
2AB在不同温度和压强改变的条件下产物AB的生成情况如图所示,a为500℃,b为反应在300℃时情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
A.A2、B2、AB均为气体,△H<0
B.AB为气体,A2、B2中有一种为非气体,△H<0
C.AB为气体,A2、B2中有一种为非气体,△H>0
D.AB为固体,A2、B2中有一种为非气体,△H<0
二、非选择题(共60分)
11.(8分)有一体积可变的密闭容器,在该容器中盛放着已经达到平衡的氢气、碘和碘化氢的混合气体。若保持温度不变,改变容器里混合气体的压强。 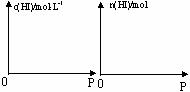 试在以下两个直角坐标系里分别绘出与碘化氢相关的物理量和压强的曲线图。
试在以下两个直角坐标系里分别绘出与碘化氢相关的物理量和压强的曲线图。
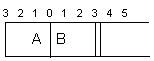 12.(12分)如图所示,温度不变,将某容器分隔为A、B两部分,A容器固定不变,B有可移动的活塞,现在A中充入2 molSO2和1 molO2,在B中充入2 molSO3和1molN2
12.(12分)如图所示,温度不变,将某容器分隔为A、B两部分,A容器固定不变,B有可移动的活塞,现在A中充入2 molSO2和1 molO2,在B中充入2 molSO3和1molN2
,在相同条件下发生可逆反应:2SO2(g) O2(g) ![]() 2SO3(g),根据下列要求填写空白:
2SO3(g),根据下列要求填写空白:
(1)固定活塞位置在3处不动,达到平衡后,设A中压强为PA,B中压强为PB,则PA与PB的压强是PA PB (填“<”、“>”、“=”)。
(2)若要使A中与B中平衡状态相同,可移动活塞的位置应在 处。
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol,则x和y的关系_________(填“<”、“>”、“=”),理由是__________。
13.(12分)钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l) KCl(l) ![]() NaCl(l) K(g);ΔH>0。各物质的沸点与压强的关系见下表:
NaCl(l) K(g);ΔH>0。各物质的沸点与压强的关系见下表:
|
压强(kPa) |
13.33 |
53.32 |
101.3 |
|
K的沸点(℃) |
590 |
710 |
770 |
|
Na的沸点(℃) |
700 |
830 |
890 |
|
KCl的沸点(℃) |
1437 | ||
|
NaCl的沸点(℃) |
1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为_________,而反应的最高温度应低于____________。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是___________________。
14.(12分)将a mol A(g),d mol D(g)置于体积可变的密闭容器中加热至一定温度,发生如下反应:2A(g) ![]() 2B(g) C(g) ; 2D(g) C(g)
2B(g) C(g) ; 2D(g) C(g) ![]() 2E(g)
2E(g)
t min时建立平衡,平衡时测得B的物质的量为m mol,C的物质的量为n mol,试回答:
(1)平衡时,D的物质的量为 mol(用含d、m、n的代数式表示,下同)。
(2)平衡时若温度压强与反应前相同,则反应前和平衡时气体的密度之比为_____________
_______。
15.(16分)537℃、1.01×105Pa时,往容积可变的密闭容器中充入 2molSO2、1molO2,此时,容器的体积为200L。向容器中加入催化剂(固体)并保持恒温恒压,发生反应:,2SO2(g) O2(g) ![]() 2SO3(g) ,达到平衡时,平衡气体SO3的体积分数为0.91。
2SO3(g) ,达到平衡时,平衡气体SO3的体积分数为0.91。
试回答下列问题:
(1)工业上二氧化硫的催化剂氧化采用常压而不采用高压的原因是:_____________________。
(2)保持上述温度和压强不变,若向容器中只充入2molSO3并加入固体催化剂。则平衡时,SO2的体积分数是______,容器的体积为_________。
(3)温度仍保持537℃,容器体积保持200L不变(恒容)。充入amolSO2,bmolO2,并国入固体催化剂,反应达到平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105Pa。若a:b=2:1,则a=_______。
