高 三 化 学
(第二学期第6周)
【教学内容】
化学应速率化学平衡
【教学目标】
1、熟练把握,化学反应速率的概念、计算以及影响因素。
2、熟练把握化学平衡的基本概念、影响因素及化学平衡移动的原理。
【知识讲解】
一、化学反应速率
1、概念:所谓化学反应速率即表示一个化学反应进行的快与慢(不仅仅局限可逆反应、
适用所有的化学反应),最初就是用快(象H2、O2爆炸)慢(铁生锈),这快、慢是定性描述。如何定量表示化学反应速率?
单位时间内反应物浓度的减小或生成物浓度的增加来表示。其数学表达式为:v= ![]()
注重:①v是平均速率还是瞬时速率?(平均,因为开始时浓度大、速率大)
②当反应物是固体时能否定量表示反应速率?(能,虽然固体不能讲浓度,但用单位时间物质的量减小或增大来表示)
③同一反应用不同物质表示反应速率数值是否一定相同?(不一定,但表示的意义完全相同)。同一反应中,各物质的速率之比一定等于其计量系数之比。
2、影响化学反应速率的条件
(1)主要(决定性)因素——反应物本身的性质。但同一反应,不同条件,反应速率不相同。
(2)外界条件①浓度:其它条件不变,增大反应物浓度v加快。
例如:硫在纯氧中燃烧比在空气中燃烧更剧烈等。
注重:浓度一般指气体或溶液,纯液体或固体浓度是一定值,量的增减一般不影响反应速率。对可逆反应,浓度改变可以是反应物或生成物或同时改变,但均符合“浓快稀慢”的规律。
②压强:对有气体参加的反应,温度不变,增大压强,v加快,减小压强, v减慢。
注重:①压强改变针对气体而言,固体或液体,压强对其没有影响。
②针对可逆反应,压强对v正、v逆影响相同,但影响程度不一定相同。
③压强的改变,本质上是改变气体的浓度,因此,压强改变,要害看气体浓度有没有改变,v才可能改变。
![]() 例:反应C(s) H2O(g) CO(g) H2(g)在可变容积的密闭容器中进行,下列的改变,对化学反应速率的影响如何?
例:反应C(s) H2O(g) CO(g) H2(g)在可变容积的密闭容器中进行,下列的改变,对化学反应速率的影响如何?
A、增加碳的量 B、容器的体积缩小一半 C、保持体积不变,充入N2,使体系的压强增大一倍 D、保持压强不变充入N2。
解析:增加碳的量,不影响反应速率,因为固体浓度是一定值。容器体积缩小一半(即增大压强),气体浓度变大v加快。当充入N2,由于容器体积不变,尽管压强增大,但气体的浓度并未改变。因此v不变。而充入N2,保持压强不变。容器的体积一定要扩大,此时气体浓度一定减小,v一定要减小。
(3)温度:其它条件不变,温度越高,v越大,温度越低, v减小。
温度对化学反应速率的影响较大,每升高100C,v增大至原来的2~4倍,因此,在实际生产中,绝大多数是在高温下进行。
思考:①温度每升高100C,反应速率增大为原来的a倍,现升高了500C现反应速率是原来的多少倍?(a5倍)
②反应M N→P,每升高100C,反应速率增加3倍,在100C时完成反应的10%需81分钟,现将温度提高到300C,完成反应的10%,需要几分钟(9分钟)
注重:①温度对v影响与物质聚集状无明显关系
②可逆反应,不管放热还是吸热反应,正、逆反应速率均要加快但影响程度不同。
例:使Zn与10%的稀硫酸反应速率比Zn与12%H2SO4反应速率大,最适宜的方法是什么?(加热)
(4)催化剂——改变化学反应速率,通常有正、负之分。使用催化剂的反应较多,有些反应实用性只有在使用催化剂才能体现出来,非凡是石油化工生产。
注重:①催化剂不能使本身不发生反应的反应发生。
②工业生产中要防止催化剂中毒
③催化剂对正逆反应的速率影响是相同的
(5)其它因素:如光、颗粒大小、溶剂等。
二、化学平衡
研究对象:可逆反应的反应规律,即可逆反应进行到什么程度的基本理论。
1、可逆反应:相同条件既能向正反应方向进行,同时又能向逆反应方向进行的反应,
即不可能完全进行的反应,多数化学反应为可逆反应,差别是正、逆反应进行的程度不相同。即使进行得较完全的中和反应亦为可逆(盐类水解)。
2、化学平衡状态
特点:“等”:v正=v逆,这是反应是否处于平衡的根本原因。
“动”:动态平衡,v正=v逆≠0,正、逆反应仍在进行。
“定”:达到化学平衡,各组分的百分含量不变。
“变”:化学平衡是相对的,外界条件改变,化学平衡可能被破坏。
思考1、v正=v逆,可否理解成单位时间内生成物浓度的变化和反应物浓度变化表示的
反应速率数值相等?
(不能,指的是同一物质在单位时间内消耗的量与生成的量相等)
![]()
![]()
![]()
![]() 2、反应A2(g) B2(g) 2AB(g)达到化学平衡的标志是
2、反应A2(g) B2(g) 2AB(g)达到化学平衡的标志是
A、单位时间内消耗nmolA同时消耗nmolB.
B、 单位时间内消耗nmol A同时生成了nmolB.
C、压强不随时间变化而改变。
D、 单位时间打断nmol A—A共价键同时打断2nmol A—B共价键。
(答:B、D)
3、影响化学平衡的条件
(1)浓度:增大反应物浓度、平衡向正反方向移动,
减小反应物浓度,平衡向逆反方向移动。
上述变化可用速率——时间图象来说明。
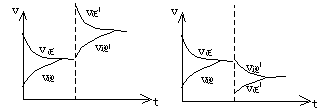 |
![]() 例:在一恒容密闭容器中,反应A(g) B(g) C(g)达到平衡,若增大A的浓度,使
例:在一恒容密闭容器中,反应A(g) B(g) C(g)达到平衡,若增大A的浓度,使
平衡右移,并达到新的平衡,下列说法正确的是
A、A的浓度一定比原平衡大 B、A的转化率增大
C、C的百分含量一定大于原平衡C的百分含量 D、B的转化率一定增大
解析:增大A的浓度,尽管平衡右移,但加入的A不可能全部转化。平衡时A的浓度一定比原平衡大,而A的转化率不一定增大。因为A的总量在增大。同理C的百分含量也不一定增大。而平衡右移B的转化率一定增大,正确答案A、D。
(2)压强——要有气态物质存在,改变压强,才可能使平衡移动。
![]() 例 2NO2(g) N2O4(g) 增大压强平衡向正方向移动,混合气体的颜色先变深后变
例 2NO2(g) N2O4(g) 增大压强平衡向正方向移动,混合气体的颜色先变深后变
浅。
思考:①上述平衡体系,增大压强、速率——时间图象如何表示?
②上述平衡体系颜色a,增大压强瞬间颜色为b,达到新平衡时,颜色为c,则颜色最深的为______,最浅的为______。
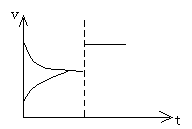
![]() ③H2(g) I2(g) 2HI,达到平衡后,加压,速率——时间图象如何变化?混合气体颜色如何变化?
③H2(g) I2(g) 2HI,达到平衡后,加压,速率——时间图象如何变化?混合气体颜色如何变化?
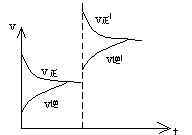 (① ②b、a ③
(① ②b、a ③
平衡不移动,颜色变深)
(3)温度——所有化学反应均具有能量变化,温度改变,化学平衡一定移动。
例:1molX(g)和1molY(g)和催化剂一起放入反应容器中、发生如下反应:
X(g) Y(g) Z(g),经过一段时间后,产物Z的压强与温度关系如图:
(1) 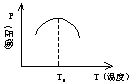 当温度T<T0时,v正和v逆关系?
当温度T<T0时,v正和v逆关系?
(2)当温度T>T0时,v正和v逆关系?
(3)该反应的正反应是吸热还是放热反应?指出判定依据。
解析:当温度T<T0时,随着温度升高,Z的压强逐渐增大,说明反应向正方向进行,v正>v逆,而当T=T0时,恰好处于平衡状态,v正=v逆。正反应显然为放热反应,因为T0是处于平衡状态,温度再升高,Z的压强在减小,说明平衡破坏,反应向逆方向进行。
(4)催化剂——只改变反应速率,而平衡不移动。
![]() 思考:A(g) 3B(g) 2C(g) Q(Q>0)达到平衡,改变下列条件,正反应速率始终增大,直达到新平衡的是
思考:A(g) 3B(g) 2C(g) Q(Q>0)达到平衡,改变下列条件,正反应速率始终增大,直达到新平衡的是
A、升温 B、加压 C、增大[A] D、降低[C] E、降低[A]↓
[注重正反应速率始终增大,这要害词,D、E就不必改虑,因为降低浓度,不管平衡如何移动,v正均要降低。其次最好画出v—t图,就能清楚看出正确答案。
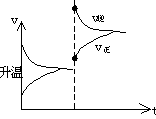 |
v正始终增大(尽管平衡左移)
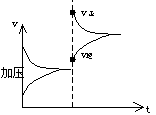 |
v正忽然增大,但又逐渐减小,同理C答案
也不合题意,正确答案为A]
三、合成氨工业
![]() 1、选择适宜的条件:根据N2 3H2 2NH3 Q这一反应的特点,运用化学反应速
1、选择适宜的条件:根据N2 3H2 2NH3 Q这一反应的特点,运用化学反应速
率和化学平衡的理论来选择适宜条件。该反应为可逆、体积减小、正反应为放热等特点。
(1)适宜的压强:为何强调适宜?压强越大、有利于NH3的合成,但太大,所需动力大,材料强度高,设备制造要求高,成本提高,选择2×107~5×107Pa压强。
![]() 思考:工业上生产H2SO4:2SO2(g) O2(g) 2SO3(g)为何不采用加压方法?(因为在常压下SO2的转化率已达91%,不需要再加压)
思考:工业上生产H2SO4:2SO2(g) O2(g) 2SO3(g)为何不采用加压方法?(因为在常压下SO2的转化率已达91%,不需要再加压)
(2)适宜的温度:温度越低越有利于NH3的合成,为何还要选择5000C高温?因为温度越低,反应速率越小,达平衡时间长,单位时间产量低,另外5000C时,催化剂活性最大。
(3)使用催化剂
(4)及时分离出NH3,并不断补充N2和H2(N2要过量,提高成本较高的H2转化率)
【能力练习】
一、选择题(每小题有1~2个正确答案)
![]() 1、对于反应A2 3B2 2AB3以下表示的反应速率中,速率最大的是
1、对于反应A2 3B2 2AB3以下表示的反应速率中,速率最大的是
A、vA=0.4mol·L-1min-1 B、vB=0.8mol·L-1min-1
C、v ![]() =0.6mol·L-1min-1 D、v
=0.6mol·L-1min-1 D、v ![]() =0.01mol·L-1·S-1
=0.01mol·L-1·S-1
2、在2L密闭容器中,盛有2mol X和2molY物质进行如下反应:
![]() X(s) 3Y(g) Z(g),当反应进行到10s后,测得生成0.5mol Z,这期间的平均反应速率为
X(s) 3Y(g) Z(g),当反应进行到10s后,测得生成0.5mol Z,这期间的平均反应速率为
A、vX=0.05mol·s-1 B、vX=0.025mol·L-1·s-1
C、vy=0.05mol·L-1·s-1 D、vy=0.075mol·L-1·s-1
3、现有三个体积相等的密闭容器中都进行如下反应:
![]() CO2 H2 CO H2O(g),反应所处的温度相同,但反应的起始浓度不同,其中甲:
CO2 H2 CO H2O(g),反应所处的温度相同,但反应的起始浓度不同,其中甲:
[H2]=[CO]=amol 乙:[CO2]=amol [H2]=2amol 丙[CO2]=[H2]=[H2O]=amol,达到平衡时,CO的浓度由大到小的顺序排列正确的是
A、丙>甲>乙 B、甲>乙>丙 C、乙>丙>甲 D、乙>甲>丙
4、在一个固定体积的密闭容器中,放入mmol的A和nmol的B,发生如下反应:
![]() mA(g) nB(g) PC(g),平衡时C的浓度是wmol·L-1,若维持容器的体积不变,起始时放入amolA、bmolB和cmolC,要使平衡时C的浓度仍为wmol·L-1,则a、b、c必须满足的条件是
mA(g) nB(g) PC(g),平衡时C的浓度是wmol·L-1,若维持容器的体积不变,起始时放入amolA、bmolB和cmolC,要使平衡时C的浓度仍为wmol·L-1,则a、b、c必须满足的条件是
A、a:b:c=m:n:p B、a:b=m:n和 ![]()
C、 ![]() 和
和 ![]() D、a=
D、a= ![]() , c=
, c= ![]() 和c=
和c= ![]()
5、对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知:
A、化学反应速率变化时,化学平衡一定发生移动。
B、化学平衡发生移动时、化学反应速率一定变化。
C、正反应进行的程度大、正反应速率一定大。
D、只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况。
![]() 6、在PCl5(g) PCl3(g) Cl2(g),达到平衡后,其它条件不变,向平衡体系中加入37Cl2,达到新平衡后,含37Cl的PCl3的物质的量与原平衡相比
6、在PCl5(g) PCl3(g) Cl2(g),达到平衡后,其它条件不变,向平衡体系中加入37Cl2,达到新平衡后,含37Cl的PCl3的物质的量与原平衡相比
A、增大 B、减小 C、不变 D、不能确定
7、下列事实不能用勒沙特列原理说明的是
A、往氢硫酸溶液中加入盐酸,[S2-]降低。
B、 温度不变时,敞口久置于空气中的饱和KNO3溶液含有晶体析出。
C、在合成氨的工业生产中,使用较高的温度有利于提高产量。
D、 在密闭容器中,水面上方的蒸气压强随温度升高而增大。
8、 ![]()
![]() 下列平衡:C2H2 H2 C2H4……① 2CH4 C2H4 2H2……②当降低温度时,①式
下列平衡:C2H2 H2 C2H4……① 2CH4 C2H4 2H2……②当降低温度时,①式
![]()
![]() 向右移动,②式向左移动,试判定下列式中C 2H2 CH4 Q1 2C H2 C2H2 2Q2
向右移动,②式向左移动,试判定下列式中C 2H2 CH4 Q1 2C H2 C2H2 2Q2
![]() 2C 2H2 C2H4 2Q3 Q1、Q2、Q3的大小顺序为
2C 2H2 C2H4 2Q3 Q1、Q2、Q3的大小顺序为
A、Q1>Q2>Q3 B、Q1> Q3> Q2 C 、Q2> Q1 >Q3、 D、Q2>Q3 >Q1
![]() 9、在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2 4Cl- [CuCl4]2- 4H2O能使黄绿
9、在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2 4Cl- [CuCl4]2- 4H2O能使黄绿
(蓝) (绿)
色CuCl2溶液向蓝色转化的操作是
A、蒸发浓缩 B、加水稀释 C、加入AgNO3 D、加入食盐晶体
![]() 10、反应A(g) xB(g) yC(g),将A与B按体积比1:x混合反应当A的转化率是50%时,反应前混合气体的密度是反应后混合气体密度的
10、反应A(g) xB(g) yC(g),将A与B按体积比1:x混合反应当A的转化率是50%时,反应前混合气体的密度是反应后混合气体密度的 ![]() (同温同压),则x、y的值可能是
(同温同压),则x、y的值可能是
A、3,4 B、3,2 C、3,3 D、1,1
![]() 11、在容积一定的密闭窗口中,反应A B(g) C(s)达平衡,若继续升高温度,容器内气体的密度增大,下列判定正确的是
11、在容积一定的密闭窗口中,反应A B(g) C(s)达平衡,若继续升高温度,容器内气体的密度增大,下列判定正确的是
A、压强对该反应的平衡移动没有影响
B、 在平衡体系中加入C,混合气体平均分子量增大
C、若正反应为吸热反应,则A为非气态
D、 若正反应为放热反应,则A为气态
12、 ![]() 某温度下,反应H2(g) I2(g) 2HI(g) Q,在一带有活塞的密闭容器中达到平衡,
某温度下,反应H2(g) I2(g) 2HI(g) Q,在一带有活塞的密闭容器中达到平衡,
下列说法不正确的是
A、恒温压缩体积,平衡不移动,颜色加深
B、 恒压迅速充入HI,开始时正反应速率减小
C、恒容,升温正反应速率减小
D、 恒容,充入H2,I2的百分比含量降低
二、填空
![]() 1、t0C在VL密闭容器中加入vmol N2和3vmol H2,当反应N2 3H2 2NH3达平衡时,
1、t0C在VL密闭容器中加入vmol N2和3vmol H2,当反应N2 3H2 2NH3达平衡时,
混合气体中N2、H2、NH3分别为A、B、Cmol,仍在t0C,若只改变起始物的加入量,但要维持A、B、C值不变,则在N2、H2、NH3的加入量用X、Y、Z表示,应满足的条件是
(1)若X=0,Y=0,则Z=_______
(2)若X=0.75vmol,则Y=________ Z=________
(3)X、Y、Z应满足的一般条件,用X、Y、Z的方程式表示式是
______________________________、________________________。
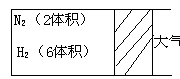 2、在一定温度下,把2体积
2、在一定温度下,把2体积
N2和6体积H2通入一个带有活
塞的容积可变的容器中,活塞的
一端与大气相通,发生反应
![]() N2 3H2 2NH3 Q达到平衡,测得混合气体为7体积
N2 3H2 2NH3 Q达到平衡,测得混合气体为7体积
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2、NH3体积,若反应达到平衡后,混合气体中各物质的百分含量仍与上述平衡完全相同,那么:
①若a=1, c=2则b=_____,在此情况下,反应起始时将向_____方向进行。
②若规定起始时反应向逆方向进行,则C的取值范围是______________
(2)在上述装置中,若起始时的a、b、c值均与(1)相同,但需控制平衡后混合气
体为6.5体积,则可采取措施是______,其原因是______。
3、在一个容积不变的反应容器中,要求通过调节体系的温度使下列反应达到平衡时保
![]() 持容器内气体总物质的量为12mol,A(g) 2B(g) 2C(g)。现向反应器中加入6.5molA,X molB,2.0 molC.
持容器内气体总物质的量为12mol,A(g) 2B(g) 2C(g)。现向反应器中加入6.5molA,X molB,2.0 molC.
(1)若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应为_____热反应。
(2)欲使起始反应维持向逆方向移动,则x取值范围是__________
【能力练习答案】
一、选择题
1、 D 2、AD 3、D 4、B 5、B 6、A 7、C 8、B
9、BC 10、BD 11、CD 12、C
二、填空题:
1、 (1) 2vmol (2)2.25v, 0.5v (3) x 2z=v Y ![]() Z=3V
Z=3V
2、 (1) ①3,逆 ② 1<c≤4
(2) 降温,因为正反应是放热反应且是体积减小的反应(不能加压因为与外界大气
相通)
3、(1)放 (2)2.5<x<3.5
