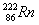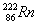推荐文章
- 化学计算专项训练三及答案
- 化学学科高考模拟试卷
- 化学反应速率和化学平衡
- 化学反应速率 化学平衡
- 化学元素及化合物所有化学方程式
- 08届高三化学第一学期期终考试模拟卷3
- 08届高三化学第一学期期中统一考试
- 08届高三化学第9月测试题
- 08届高三化学碱金属单元测试题1
- 08届高三化学电解质溶液专题练习
- 08届高三化学氧碳氮知识测试
- 08届高三化学暑期统一考试试题
08届高三化学第一学期期中考试试题
08届高三化学第一学期期中考试试题
高 三 化 学 试 题
本试卷分选择题(第1题~第14题,共48分)和非选择题(第15题~第21题共72分)两部分,满分120分,考试用时100分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32
Cl-35.5 Be—9 Na-23 Fe—56 Ba—137
一、单项选择题:本题有8小题,每小题3分,共24分。每小题只有一个选项符合题意。
1.正确把握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A. ![]() Bi和
Bi和 ![]() Bi都含有83个中子
Bi都含有83个中子
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
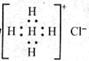 C.SiH4、PH3、HCl的稳定性逐渐增强
C.SiH4、PH3、HCl的稳定性逐渐增强
D.Ca2 的结构示意图为 NH4Cl的电子式为
2.下列4组连线中,完全正确的一组是
A.  B.
B. 
C.  D.
D. 
3.下列有关物质类别判别的依据正确的是
A.原子晶体:晶体的熔点是否很高 B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键 D.共价化合物:是否含有共价键
4.目前人类已发现的非金属元素除稀有气体外,共有16种。下列对这16种非金属元素的相关判定:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态,所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成酸
A.只有②③正确 B.只有①③正确
C.只有④正确 D.均不正确
5.生产、生活离不开各种化学物质,下列说法不正确的是
A.不需要通过化学反应就能从海水中获得食盐和淡水
B.潜水艇在紧急情况下可用过氧化钠供氧
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.工业上常用单质硅作为光导纤维;用铝粉还原一些金属氧化物来制金属
6.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
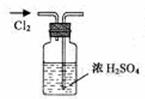
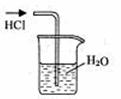
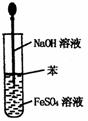
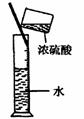
A.干燥Cl2 B.吸收HCl C.制取Fe(OH)2沉淀 D.稀释浓H2SO4
7.下列有关热化学方程式的叙述中,正确的是
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出 28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(l)△H=十57.4 kJ/mol
B.已知C(石墨,s)=C(金刚石,s);△H> 0,则金刚石比石墨稳定
C.已知2H2(g)十O2(g)=2H2O(g);△H=-483.6 kJ/mol,
则H2的燃烧热为 241.8 kJ/mol
D.已知 2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2
则△H1<△H2
8.浓度不等的两种硫酸溶液等质量混合后,溶液的质量分数为a%,而等体积混合后,溶液的质量分数为b%;浓度不等的两种氨水等质量混合后,其质量分数为a%,而等体积混合后,溶液的质量分数为c%,那么a、b、c数值的关系是
A. a>b>c B. b>a>c C. c>b>a D. c>a>b
二、不定项选择题:本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分。
9.设阿伏加德罗常数的值为6.02×1023,下列叙述中正确的是
A.2.24L(标准状况)Cl2与足量Ca(OH)2在常温下反应,转移的电子数为1.2 04×1022
B.常温常压下,92gNO2和N2O4混合气体中含有的原子数为3.612×1024
C.12.5 mL 16 mol/L浓硫酸与足量铜共热,可生成SO2的分子数约为6.02×1022
D. 23 g Na和足量的O2完全反应,无论是常温,还是燃烧,都失去6.02×1023个电子
10.下列离子在溶液中能大量共存,且加入(NH4)2Fe(SO4)2·6H2O晶体后仍能大量存在的是
A.Na+ 、H+ 、Cl- 、NO3- B.K+ 、Ba2+ 、OH- 、I-
C.Na+、 Mg2+ 、Cl- 、SO42- D.Cu2+ 、 S2- 、Br- 、ClO-
11.下列离子方程式书写正确的是
A.用氨水溶解氯化银沉淀:Ag Cl+2 NH3·H2O=[Ag(NH3)2] +2 H2O + Cl-
B.向Ba(OH)2溶液中滴加Na HSO4溶液至刚好沉淀完全:
Ba2 2OH- 2H SO42—=BaSO4↓ 2H2O
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2 H2O2 2H =2Fe3 2H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO- SO2 H2O = HClO HSO3—
12.水热法制备Fe3O4纳米颗粒的反应是3Fe2 2S2O ![]() O2 xOH—
O2 xOH— Fe3O4 S4O ![]() 2H2O,下列说法中正确的是
2H2O,下列说法中正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为4mol
B.Fe2 和S2O ![]() 都是还原剂
都是还原剂
C.1mol Fe2 被氧化时,被Fe2 还原的O2的物质的量为1/3mol
D.x=2
13.工业上根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2 NH3 H2O NaCl = NaHCO3↓ NH4Cl的反应原理,最终可制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:
气体A的饱和溶液 eq \o(——→,\s\up8(加入食盐) ,\s\do7(Ⅰ))加入食盐ⅠA和食盐的饱和溶液 eq \o(———→,\s\up8(通入足量气体B) ,\s\do7(Ⅱ))通入足量气体BⅡ悬浊液 eq \o(—→,\s\up8(过滤) ,\s\do7(Ⅲ))过滤Ⅲ晶体 eq \o(—→,\s\up8() ,\s\do7(Ⅳ))Ⅳ纯碱
则下列叙述错误的是
A.A气体是NH3,B气体是CO2
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
14.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.K+一定存在 B. 100mL溶液中含0.01mol CO32-
C.Cl-可能存在 D. Ba2+一定不存在,Mg2+可能存在
三、本题包括2小题,共20分。
15.(1)下列说法正确的是 ( )
A.实验室可由FeSO4溶液蒸干制得FeSO4·7H2O晶体
B.向容量瓶中转移溶液时,玻璃棒下端应位于刻度线下方
C.用通入适量O2并加热反应的方法可除去CO2中混有的CO
D.除去MgCl2酸性溶液中混有的FeCl3,可加入足量MgO粉末,充分搅拌、过滤
E.配制100mL 1mol/L NaCl溶液,可用托盘天平称量5.85g固体食盐
F.为加快过滤速度,过滤时可用玻璃棒轻轻搅拌
(2)根据中学化学实验规范,完成下列填空:
①做钠与水反应实验时,取用金属钠的操作方法 _______________________________
________________________________________________________________________
②检验溶液中钾离子的操作方法 ____________________________________
________________________________________________________________________
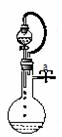
16.下列仪器组合装置可以实现不同的实验目的。
|
D |
|
A |
|
B |
|
C |

(1)该装置检查气密性的方法是 _________ ___________________________
(2)若A中盛浓氨水,B中放氧化钙,通过化学反应可以生成氨气,反应方程式为_________________________________________。该实验中有大量氨气逸出的原因是____________________________________;______________________________。(说明两点)
(3)若C中放水,通过排水法可以测量NH3体积,则应对C装置采取何种措施,才能使排水量气法顺利进行,且测量结果较为准确。
______________________________________________________________________
(4)若A中放稀H2SO4,B中放镁铝混合物,用该装置可以测定混合物中镁的质量分数,有同学提出用如右图装置代替原A、B组合装置,从实验的可进行性以及实验结果的准确性来看,这样做至少有以下两点好处:_________________________ _______,__________________ ____________。
(5)实验结束时,为保证结果的可靠性,在测量量筒中水的体积时,应注重________________________________________ ____(至少答两点原因)
四、本题包括2小题,共20分。
17.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e- → NO+2 H2O
在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现的性质是: 、 。
(3)反应生成0.3mol H2O,则转移电子的物质的量是 mol。
(4)若反应后还生成KIO3,且其它物质保持不变,则反应中氧化剂与还原剂的物质的量之比将 (填“增大”、“减小”、“不变”或“不能确定”)。
18. U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,其在W2中燃烧可生成淡黄色固体。Z的单质在W2中燃烧的产物可使品红溶液褪色。Y的单质也是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;Y W的电子式为____________;
(2)U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)___ _________,用一个离子方程式加以证实___________________________________________。
(4)ZW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________。
五、本题包括2小题,共22分。
19.铍是金属中最好的良导体。因它有极好的吸热、散热性能,故有许多超音速飞机的制动装置是用铍来制造的。当人造地球卫星和宇宙飞船穿上铍的“防热外套”时,能够及时吸收因穿越大气层摩擦而产生的热量并很快散发出去,从而保障飞船的飞行安全。
铍还是高效率的火箭燃料,铍在燃烧时能释放出巨大的能量:每1kg的铍完全燃烧放出的热量为62700kJ。另外,几乎各种各样的原子反应堆都要用铍做中子反射体。要建设一个大型的原子反应堆,往往需要动用2吨金属铍。
根据上述信息,请回答下列问题:
= 1 \* GB3 ①试写出铍燃烧的热化学反应方程式: 。
= 2 \* GB3 ②氧化铍、氢氧化铍性质类似于氧化铝、氢氧化铝,则氧化铍为 氧化物(填“酸性”或“碱性”或“两性”)。
= 3 \* GB3 ③假如氢氧化铍与碱反应生成的阴离子中铍原子最外层电子数满足8电子结构,试写出氢氧化铍与氢氧化钠溶液反应的化学反应方程式: 。
= 4 \* GB3 ④写出氧化铍与盐酸反应的离子反应方程式: 。
= 5 \* GB3 ⑤能有效除去水中铍离子的试剂是: 。
A、氨水 B、碳酸钠溶液 C、稀硫酸 D、氢氧化钠溶液
20.下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
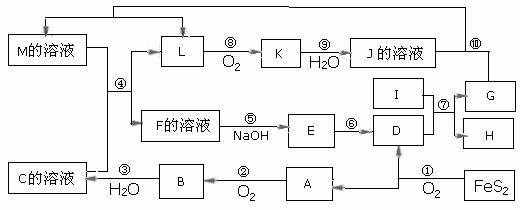
请填写下列空白:
(1)在周期表中,组成单质G的基态原子电子排布式为_____ _______。
(2)G在空气中发生吸氧腐蚀时原电池负极的电极反应式为_ ______ ___。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________
(填写序号)。
(4)反应④ 的离子方程式是:_______________________________________
(5)I与烧碱溶液反应的离子方程式是:___________________________ ________
( 6 )将化合物D 与KNO3、KOH 共熔,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:
_____________________________________________________________________。
六、本题包括1小题,共10分。
21. (1)现以含铁元素50%的铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨? (保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。
① 计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末 分别加到100mL相同浓度的H2SO4溶液中,充分反 应后,测得的实验数据如下表所示:
|
实验序号 |
I |
II |
III |
|
加入钢样粉末的质量/g |
2.812 |
5.624 |
8.436 |
|
生成气体的体积/L(标准状况) |
1.120 |
2.240 |
2.800 |
计算该硫酸溶液的物质的量浓度。
高三化学参考答案及评分标准
一、单项选择题(本题包括8小题,每小题3分,共24分)
1.C 2.A 3.C 4.D 5.D 6.C 7.D 8.B
二、不定项选择题(本题包括6小题,每小题4分,共24分)
9.B D 10. C 11.A C 12.A B 13.D 14.A C
三、四、五、六、非选择题部分(包括7小题,共24分)
15.(1)B D (2分)
(2)①用镊子从试剂瓶中取出金属钠块,然后用小刀切下黄豆大小的一块(多余的放回原瓶),再用滤纸吸干表面煤油。 (2分)
①将铂丝用稀盐酸洗净,在酒精灯火焰上灼烧至无色;②用洗净的铂丝沾取少量待测液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察焰色。 (2分)
16.(1)关闭分液漏斗活塞,对烧瓶外壁微微加热,若洗气瓶中右端玻璃管形成一段水柱,且能保持一段时间不下降,说明此装置气密性良好。 (2分)
(2)NH3·H2O CaO === Ca(OH)2 NH3↑ (2分)
![]()
![]() ①CaO与水反应放出热量,使NH3在水中溶解度降低而逸出 (2分) ②溶液中OH-浓度增大,使平衡NH3 H2O NH3·H2O NH4 OH-逆向移动,有利于NH3逸出 (2分)
①CaO与水反应放出热量,使NH3在水中溶解度降低而逸出 (2分) ②溶液中OH-浓度增大,使平衡NH3 H2O NH3·H2O NH4 OH-逆向移动,有利于NH3逸出 (2分)
(3)在C中水面上覆盖一层植物油 (2分)
(4)①有利于分液漏斗中液体顺利滴下(分液漏斗上方和烧瓶内气压相同) (1分)
②防止滴下的溶液排出相应体积的气体从而产生误差 (1分)
(5)①待气体温度恢复到常温 (1分)
②上下移动量筒,使量筒中液面和广口瓶液面相平 (1分)
③读数时平放量筒,使视线与液面最底处保持水平
17.(1)8HNO3 6KI === 3I2 2NO 4H2O 6KNO3 (2分)
(2)酸性 氧化性 (2分)
(3)0.45 (2分)
(4)增大 (2分)
![]() 18.(1)N≡N Mg2 [ ]2- (4分)
18.(1)N≡N Mg2 [ ]2- (4分)
(2)① ③ (2分)
(3)CH4 NH3 (2分)
![]() NH3 H2O NH4 OH-(或NH3 H3O === NH4 H2O) (2分)(4)3SO2 2H2O 3Ba2 2NO3-=== 2NO 3BaSO4 4H (2分)
NH3 H2O NH4 OH-(或NH3 H3O === NH4 H2O) (2分)(4)3SO2 2H2O 3Ba2 2NO3-=== 2NO 3BaSO4 4H (2分)
19.2Be (s) O2(g)=== 2BeO (s); △H= -1128.6 kJ /mol (3分)
两性 Be(OH)2 2NaOH === Na2Be(OH)4 (3分)
BeO 2H == Be2 H2O A、B (4分)
20.(1)1s22s22p63s23p63d64s2 (2分)
(2)Fe - 2e- == Fe2 (2分)
(3)3 (2分)
(4)3Fe2 4H NO3-=== 3Fe3 NO 2H2O (2分)
(5)2Al 2OH- 2H2O === 2AlO2- 3H2↑ (2分)
(6)Fe2O3 3KNO3 4KOH === 3KNO2 2H2O 2K2FeO4 (2分)
21.(1)1×96%÷96%÷50%=2 (吨) (3分)
(2)①Fe:28g——→0.5mol
C:0.12g——→0.01mol
n(Fe):n (C)== 50:1 (3分)
② Fe——————H2
0.125mol 0.125mol
c(H2SO4)= ![]() mol/L (4分)
mol/L (4分)