| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
|
|
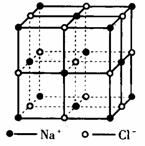
| 图1 NaCl晶体
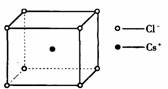
| 图2 CsCl晶体 |
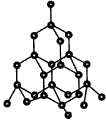
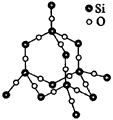
图4 金刚石晶体
图5 SiO2晶体
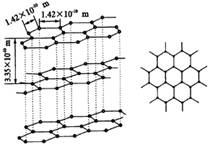
图6 石墨晶体
中学阶段所需把握的几种晶体结构类型及有关问题:
一、离子晶体
NaCl型(如图1)
1.在晶体中,每个Na+同时吸引 个Cl-,每个Cl-同时吸引着 个Na+,阴、阳离子数目之比是 。
2.在晶体结构中,每个晶胞由 个小立方体构成,每个小立方体的8个顶点分别由 个Na+、 个Cl-相邻占据,每个小立方体含Na+: 个、含Cl-: 个。故每个晶胞有NaCl微粒 个。
3.在晶体中,经过立方体的中心Na+的平面有三个,每个平面的四个顶点上的Na+都同晶体中与中心Na+最接近且距离相等。所以,在晶体中,每个Na+四周与它最接近的距离相等的Na+的个数共有 个。同理,每个Cl-四周与它最接近且距离相等的Cl-的个数也有 个。
CsCl型(如图2)
1.在晶体中,每个Cl-吸引 个Cs+,每个Cs+吸引 个Cl-,Cs+与Cl-的个数比为 。
2.每个基本结构单元中(小立方体)含Cl-: 个,含Cs+ 个。
3.在晶体中,每个Cs+四周与它最接近且距离相等的Cs+的个数共有 个。同理, 每个Cl-四周与它最接近的且距离相等的Cl-共有 个。
[拓展练习]
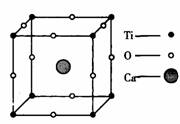 1.在高温超导领域中,有一种化合物叫钙钛矿,其晶体结构中有代表性的最小单位结构如图所示试回答:
1.在高温超导领域中,有一种化合物叫钙钛矿,其晶体结构中有代表性的最小单位结构如图所示试回答:
(1)在该晶体中每个钛离子四周与它最近且相等距离的钛离子有
多少个?
(2)在该晶体中氧、钙、钛的粒子个数化是多少?
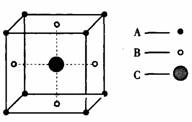 2.某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未能画出),晶体中A、B、C的中原子个数之比依次为
2.某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未能画出),晶体中A、B、C的中原子个数之比依次为
A.1:3:1 B.2:3:1 C.2:2:1 D.1:3:3
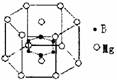 3.2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如右图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为
3.2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如右图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为
A Mg14B6 B Mg2B C MgB2 D Mg3B2
 4.如图是氯化铯晶体的晶胞(晶体中最小的重复单元),已知晶体中2个最近的Cs 离子核间距为a cm,氯化铯的式量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为
4.如图是氯化铯晶体的晶胞(晶体中最小的重复单元),已知晶体中2个最近的Cs 离子核间距为a cm,氯化铯的式量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为
A. ![]() EQ \F(8M,a3NA) g/cm3 B.
EQ \F(8M,a3NA) g/cm3 B. ![]() EQ \F(M,8a3NA) g/cm3
EQ \F(M,8a3NA) g/cm3
C. EQ \F(M,a3NA) g/cm3 D. EQ \F(Ma3,NA) g/cm3
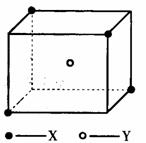 5.某离子晶体晶胞结构如图所示,x位于立方体的
5.某离子晶体晶胞结构如图所示,x位于立方体的
顶点,Y位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着__________个X,每
个x同时吸引着__________个Y,该晶体的化学式
为__________ 。
(2)晶体中在每个X四周与它最接近且距离相等
的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角
∠XYX的度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。
 6.晶体具有规则的几何外型、晶体中最基本的重复单
6.晶体具有规则的几何外型、晶体中最基本的重复单
位称为晶胞。NaCl晶体结构如图所示。已知FexO
晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1
测知FexO晶体密度为ρ=5.71 g·cm-3,晶胞边长为
4.28×10-10 m。
(1)FexO中x值(精确至O.01)为
(2)晶体中的Fe分别为Fe2 、Fe3 ,在Fe2 和
Fe3 的总数中,Fe2 所占分数(用小数表示,精确至0.001)为
______________。
(3)此晶体的化学式为 _____________。
(4)与某个Fe2 (或Fe3 )距离最近且等距离的O2-围成的空间几何外形是_____________。
(5)在晶体中,铁元素间最短距离为_____________cm
7.1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖。其晶胞结构如图。
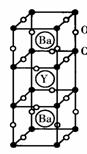
(1)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式
(2)根据(1)所推出的化合物的组成,计算其中Cu原子的平均化合价[该化合物中各元素的化合价为Y( 3),Ba( 2),Cu( 2)和Cu( 3)]试计算化合物中这两种价态Cu原子个数比。
二、分子晶体
干冰型(如图3)
 在干冰晶体中每个CO2分子四周紧邻的 CO2分子有_________个 在晶体中截取一个最小的正方形;使正方形的四个顶点落到CO2分子的中心,则在这个正方形的平面上有___________个C02分子。
在干冰晶体中每个CO2分子四周紧邻的 CO2分子有_________个 在晶体中截取一个最小的正方形;使正方形的四个顶点落到CO2分子的中心,则在这个正方形的平面上有___________个C02分子。
[拓展练习]
1.最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,如右图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是______。
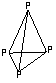 2.已知白磷是由P4分子形成的分子
2.已知白磷是由P4分子形成的分子
晶体,每个P4分子是正四面体结
构。分子中的四个磷原子位于正
四面体的四个顶点。则P4分子中
共有___________个P—P键。
 3.磷在空气中充分燃烧后生成结构如图所示的分子。图中圆圈表示原子、实线表示化学键。试回答:
3.磷在空气中充分燃烧后生成结构如图所示的分子。图中圆圈表示原子、实线表示化学键。试回答:
(1)请从图中找出磷原子,并在图上将其涂黑。
(2)形成化合物的化学式为 ________________。
(3)分子内的磷原子排列成______________形。
(4)每个磷原子处于______________中心。
(5)在用实线表示的化学键中,两原子间单线表示
的是 _________(填写非极性键或极性键)。
三、原子晶体
正四面体型 (金刚石、硅、二氧化硅)(如图4、图5)
1.金刚石晶体中,每个碳原子与4个相邻的碳原子形成4个C—C键。
2.在金刚石晶体中,由于一个碳原子所形成的4个键共有C42=6种两两相邻的组合,每个
键可形成两个近似垂直的六元环,故每个碳原子最多可形成6×2=12个六元环,一个六元环实际拥有6×(1/12)=(1/2)个碳原子。
3.在金刚石晶体中,固定一个C—C键,其余三键与该键有C31=3种两两相邻的组合,故一个C—C最多可形成3×2=6个六元环,每个六元环拥有6×(1/6)=1个C—C键。
4.硅晶体结构与金刚石晶体结构相同。
5.由上述推导过程可知:在二氧化硅晶体中,最小环为12元环(6个硅原子和6个氧原子),每个12元环实际拥有6×(1/12)=(1/2)个硅原子,拥有(1/6)×6=1个氧原子,故硅、氧原子个数比为1∶2。
四、混合型晶体
石墨型(如图6)
1.石墨晶体为层状结构。每一层中碳原子排列成六边形,一个个六边形(六元环)排列成平面的网状结构,键角120°。
2.每一个碳原子都跟相邻的碳原子以共价键相结合。因此,每个六元环拥有碳原子(1/3)×6=2个,每个环拥有C—C键(1/2)×6=3个。
3.mg石墨中,正六边形数目为(m/12)NA÷2=(mNA/24)。
[拓展练习]
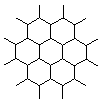 1.石墨晶体(属混合型晶体)是层状结构,在每一层内;每一个碳原
1.石墨晶体(属混合型晶体)是层状结构,在每一层内;每一个碳原
子都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图
中7个六元环完全占有的碳原子数是( )
A.10个 B.18个 C.24个 D.14个
|
SiO2平面结构 |
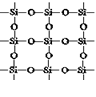
2.石英晶体的平面示意图如图所示,实际上是立体网
状结构,其中硅,氧原子个数比为____________
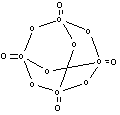
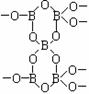 3.有一种多聚硼酸盐为无限网状结构(如右图):
3.有一种多聚硼酸盐为无限网状结构(如右图):
其结构的基本单元可表示为(B5On)m-,则m= 、
n= 。
4.
5.单质硼有无定形和晶体两种,参考下表数据
|
金刚石 |
晶体硅 |
晶体硼 | |
|
熔点 |
>3823 |
1683 |
2573 |
|
沸点 |
5100 |
2628 |
2823 |
|
硬度 |
10 |
7.0 |
9.5 |
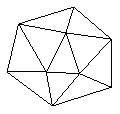
① 晶体硼的晶体类型属于____________晶体,理由是_
_______________________ 。
② 已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有1个B原子。通过视察图形及推算,此晶体体结构单元由____________________个硼原子构成。其中B—B键的键角为____________。
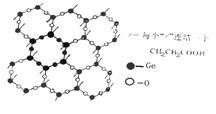 6.β-羧乙基锗倍半氧化物(即Ge-132)是与人体健康有关的最重要的有机锗化合物。其片层结构如图,每个结构相同的基团都是由六个锗原子和六个氧原子构成的十二元环,每个锗原子还同时与三个氧原子相连结,形成可以任意延伸的片层,每个锗原子连接一个羧乙基(-CH2CH2COOH),各片层间存在相互作用,连结成三维网状结构。
6.β-羧乙基锗倍半氧化物(即Ge-132)是与人体健康有关的最重要的有机锗化合物。其片层结构如图,每个结构相同的基团都是由六个锗原子和六个氧原子构成的十二元环,每个锗原子还同时与三个氧原子相连结,形成可以任意延伸的片层,每个锗原子连接一个羧乙基(-CH2CH2COOH),各片层间存在相互作用,连结成三维网状结构。
(1) 平均每个正六边形拥有_____个锗原子, _____个氧原子.
(2) 化学式为:____________________
7.1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家.C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
① 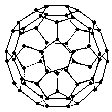 C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
② ②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30.
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是____________,理由是:
_________________________________________________________.
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可出能”)_________________________,并简述其理由:
________________________________________________________.
(3)通过计算,确定C60分子所含单键数.
C60分子所含单键数为_______________.
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知.通过计算确定C70分子中五边形和六边形的数目.
C70分子中所含五边形数为____________,六边形数为_________.
| |