|
第一学期期末调研测试卷
高三化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分为150分,考试时间120分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Br-80 Na-23 Fe-56 Cu-64
第Ⅰ卷(选择题,共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.自然界中的CaF2又称萤石,是一种难溶于水的固体。下列实验事实能说明CaF2一定是离子晶体的是
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔点较高,硬度较大
C.CaF2固体不导电,但在熔化状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
2.化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A.定性检验SO32-,将BaCl2溶液用HNO3酸化
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe2+时,用硝酸酸化
D.检验溶液中是否含有SO42-时,在无其它阳离子干扰的条件下,用盐酸酸化的BaCl2溶液
3.设NA表示阿伏加德罗常数,下列说法正确的是
A.1L1mol/L CH3COONa溶液中存在NA个CH3COO-离子
B.1molCnH2n 2含有(3n+1) NA个共价键
C.1molCl2参加化学反应获得的电子数都是2 NA
D.1molNO2气体降温后颜色变浅,其所含的分子数仍为NA
4.下列气体既能用浓硫酸干燥,又可用碱石灰干燥的是
A.CH4 B.Cl2 C.SO2 D.NH3
5.25℃时,1L溶液中由水电离出来的H+为10-12mol,则该溶液中一定不能大量存在的是
A.SO42- B.NO3- C.HCO3- D.NH4+
6.强酸和强碱稀溶液的中和热科表示为
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1
已知:①HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ·mol-1
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=-b kJ·mol-1
③HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=-c kJ·mol-1
则a、b、c三者的大小关系为
A.a>b>c B.b>c>a C.a=b=c D.无法比较
7.为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是
|
|
被提纯物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
二氧化碳(CO) |
氧化铜粉末 |
通过灼热的CuO粉末 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
8.将SO2气体通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体仍无沉淀产生。则通入的该气体可能是
A.CO2 B.NH3 C.NO2 D.Cl2
二、选择题(本题包括10小题,第9-16小题每小题4分,17、18小题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.由于碘是卤族元素中原子半径较大的元素,可能呈现金属性。下列事实能够支持这个结论的是
A.已经制得了I2O5等碘的氧化物
B.在IBr、ICl等卤素互化物中碘元素表现正价
C.已经制得了I(NO3)3、I(ClO4)3·2H2O等离子化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3-
10.氟烷的麻醉作用比吗啡强100倍,氟烷是乙烷的卤代产物,其化学式为C2HClBrF3,则沸点不同的上述氟烷有
A.1种 B.2种 C.3种 D.4种
11.丁香油酚结构简式如右图所示,下列关于它的性质说法正确的是
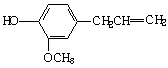 A.既可燃烧,又可使酸性KMnO4溶液褪色 A.既可燃烧,又可使酸性KMnO4溶液褪色
B.可跟NaHCO3溶液反应放出CO2气体
C.在碱性条件下可发生水解反应
D.可与浓溴水发生取代反应
12.将溶质的质量分数为a%的NaOH溶液蒸发掉m g水后,变成溶质的质量分数为2a%的NaOH不饱和溶液V mL,所得溶液的物质的量浓度为
A. 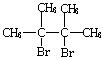 B. B. 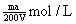
C. 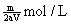 D. D. 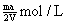
13.用体积相同、pH均为12的NaOH溶液和氨水,分别中和物质的量浓度相同的盐酸。当酸碱恰好完全反应时,NaOH溶液和氨水消耗盐酸的体积分别为V1和V2。则下列关系式正确的是
A.V1>V2 B.V1<V2 C.V1=V2 D.无法判定
14.物质的量浓度各为0.1mol·L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液呈酸性。下列关系式正确的是
A.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.c(CH3COO-)+c(CH3COOH)=0.2mol·L-1
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
15.下列离子方程式正确的是
A.氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
B.向Ba(OH)2溶液中逐滴NaHSO4溶液至溶液刚好呈中性
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.用氯化铁溶液腐蚀印刷线路铜板:Fe3++Cu=Fe2++Cu2+
D.向碳酸氢钠溶液中滴入过量石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
16.在含有Cu(NO3)2、Zn(NO3)2 、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入l铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+离子,同时析出0.1mol Ag。下列结论错误的是
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+
B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+物质的量比为1∶2
D.1molFe可还原2molFe3+
17.将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g) 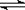 2HI(g);△H<0,并达到平衡,HI的体积分数ω(HI)随时间(t)变化如图(Ⅱ)所示。若改变反应条件,ω(HI)的变化如图(Ⅰ)所示,则改变的条件可能是 2HI(g);△H<0,并达到平衡,HI的体积分数ω(HI)随时间(t)变化如图(Ⅱ)所示。若改变反应条件,ω(HI)的变化如图(Ⅰ)所示,则改变的条件可能是
A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
 C.恒容条件下升高温度 C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
18.将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为:CH4+10OH――8e-=CO32-+7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e-=8OH-。下列叙述正确的是
A.通入甲烷的电极为负极
B.正极发生氧化反应
C.该燃料电池总反应为:CH4+2O2+28OH-=CO32-+3H2O
D.燃料电池工作时,溶液中的阴离子向正极移动
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
答案 |
|
|
|
|
|
|
|
|
|
|
题号 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共76分)
三、(本题包括2小题,共22分)
19.(8分)用序号填空:
⑴对以下课本中的各实验:
A.浓硫酸跟乙醇反应制乙烯 B.葡萄糖的银镜反应
C.乙酸乙酯的制取 D.石油的分馏
E.乙醛还原新制的氢氧化铜 F.中和热的测定
①需水浴加热的是_________________;②需要用温度计的是_________________。
⑵下列对实验操作或实验事实的叙述正确的是_____________________
①用稀HNO3清洗做过银镜反应实验的试管
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
③用碱式滴定管量取20.00mL0.1000mol·L-1的KMnO4溶液
④用托盘天平称取10.50g干燥的NaCl固体
⑤不慎将苯酚浓溶液沾到皮肤上,立即用酒精清洗
⑥向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
20.(14分)乙醇在一定条件下与溴化钠和浓硫酸反应可制备溴乙烷。已知反应物用量:NaBr固体0.24mol,C2H5OH 0.2mol (密度为0.7893g/cm3),98%H2SO4 35mL (密度1. 84g/cm3),H2O 25mL,实验产率约为60%~65%。
⑴请完成制取溴乙烷的化学方程式:__________________________________________
若按烧瓶内液体的体积不小于烧瓶容积的1/3,不大于烧瓶容积的2/3,则反应装置中烧瓶的容积最合适的是__________。
A.50mL B.100mL C.150mL D.250mL
⑵用下图仪器安装反应装置,要求达到减少反应物损失,防止环境污染的目的,有关仪器连接顺序为_______________________________(填接口数字)。
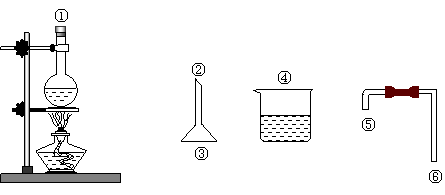
⑶反应过程中可能发生的副反应为(至少填两个):
___________________________________;____________________________________。
⑷实验结束从反应混合物中分离出粗制黄色的溴乙烷,产生黄色的原因是其含有____(填化学式)。欲得到无色的溴乙烷的方法是______________________________(填试剂和操作名称)。
⑸本实验的理论产量为______________g。
四、(本题包括2小题,共18分)
21.(8分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
⑴i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图_________。⑵以上元素形成的金属单质中,熔点最低的是____ (填元素符号)。
⑶NH3·H2O的电离方程式为NH3·H2O 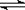 NH4++OH-,试判定NH3溶于水后,形成的NH3·H2O的合理结构是______。(填序号) NH4++OH-,试判定NH3溶于水后,形成的NH3·H2O的合理结构是______。(填序号)
⑷1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请猜测首先被用来与F2反应制备稀有气体化合物的元素是______。(填写元素符号)
⑸利用稀有气体化合物,人们实现了许多制备实验上的突破。如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出上述反应方程式:
_______________________________________________________。
22.(10分)下图中每个方框表示有关的一种反应物或生成物,方框中字母是物质代号,已知B、D、E、F、X均为单质,试填空。
⑴写出A、B的化学:A___________,B____________。
⑵写出I和J反应的化学方程式__________________________________________。
写出E和水反应的离子方程式_________________________________________。
⑶写出C溶液和D反应的离子方程式_____________________________________。
五、(本题包括2小题,共18分)
23.(8分)某有机物A由C、H、O、N四种元素组成,质量分数分别为C:54.8%,H:5.58%,N:7.11%,其余为O,A的相对分子质量不超过300。A是氨基酸,并且分子中-NH2和-COOH连在同一个碳原子上,分子中不存在甲基(-CH3),能与FeCl3溶液发生显色反应,1mol A的溶液能与3mol NaOH完全反应。
请回答:
⑴有机物A的相对分子质量为________,其分子式为________________。
⑵符合上述条件的有机物A的结构有______种,写出其中的三种结构简式:
_____________________、_______________________、________________________。
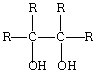
24.(10分)信息1:四烃基乙二醇叫频那醇(-R烃基可相同也可不同),
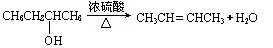 已知醇发生消去反应时,羟基优先跟相邻碳原子上含氢原子较少的碳原子上的氢原子一起消去生成烯,如: 已知醇发生消去反应时,羟基优先跟相邻碳原子上含氢原子较少的碳原子上的氢原子一起消去生成烯,如:
信息2:以下类型的卤代烃可以在热的酸性溶液中水解生成醇:
信息3:已知四烃基乙二醇(频那醇)在H2SO4作用下可经脱水、重排反应生成频那酮:
试应用上述信息、并根据下列有关的转化关系,回答问题:
⑴A、C的结构简式为A_________________C_________________。
⑵写出A→B(即反应Ⅱ)的反应方程式:
___________________________________________________________。
⑶反应Ⅰ-Ⅴ中属于加成反应的是_______________(填序号)。
⑷在以下方框中填写合适的结构简式(甲、乙互为同分异构体):
六、(本题包括2小题,共18分)
25.(6分)碳酸钠和碳酸氢钠的固体混合物2.74g在坩锅中加热至固体质量不再减少为止,残留固体2.12g。将残留固体与盐酸完全反应,消耗盐酸20mL,得NaCl溶液。
求⑴原混合物中碳酸钠的物质的量。⑵盐酸的物质的量浓度。
26.(12分)取25.0gCuSO4·5H2O晶体,加热使之均匀缓慢升温至1000℃,并恒温1小时,将带火星的木条插入产生的气体中,木条可以复燃。试通过计算回答下列问题。(已知:在1000℃时,Cu+比Cu2+稳定。)
以下是加热过程中发生的化学反应:
CuSO4·5H2O  CuSO4+5H2O↑ CuSO4 CuSO4+5H2O↑ CuSO4  CuO+SO3↑ CuO+SO3↑
4CuO  2Cu2O+O2↑ 2SO3 2Cu2O+O2↑ 2SO3 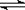 2SO2+O2 2SO2+O2
⑴充分反应后,最终固体产物颜色为_______________,其质量为_____________g。
⑵在某中间温度时,固体产物质量能否为10g?____________(填能或不能)。如可能,请计算其组成和质量,如不可能,请说明理由:
_________________________________________________________________________。
⑶假如某同学在做此实验时,最后得到固体质量为7.6g,试计算该固体的组成和质量
⑷不考虑实验带来的误差,在该反应条件下最终生成气态产物除去水后,物质的量可能为_____________。
A.0.10mol B.0.15mol C.0.20mol
南京市2005~2006学年度第一学期期末调研测试卷
高三化学参考答案
一、二题
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
答案 |
C |
D |
B |
A |
C |
B |
C |
A |
|
|
题号 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
答案 |
C |
D |
AD |
D |
B |
AC |
BD |
A |
C |
AC |
三、(本题包括2小题,共22分)
19.(8分)
⑴① B ②ADF ⑵①②⑤
20.(14分)
⑴HBr+C2H5OH  C2H5Br+H2O C C2H5Br+H2O C
⑵①⑤⑥②③④
⑶乙醇的分子间脱水生成醚、乙醇的分子内脱水生成乙烯等合理反应。
⑷Br2 NaOH溶液、洗涤、分液
⑸21.8g
四、(本题包括2小题,共18分)
21.(8分)
⑴铁原子结构示意图略 ⑵Na ⑶(b) ⑷j (或写Xe)
⑸XeO3+3NaBrO3=3NaBrO4+Xe
22.(10分)
⑴A:NaCl B:S
⑵Na2O2+SO2=Na2SO4 2Na+2H2O=2Na++2OH-+H2↑
⑶SO32-+Cl2+H2O=2H++SO42-+2Cl-
五、(本题包括2小题,共18分)
23.(8分)
⑴197 C9H11O4N
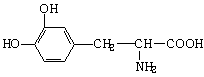
⑵6
(或其任意一种酚羟基的位置异构体)
24.(10分)
⑴A:(CH3)2C=C(CH3)2 C: 
⑵方程式略
⑶Ⅱ、Ⅴ
⑷只要合理即可,如甲为频那酮,另为消去产物
六、(本题包括2小题,共18分)
25.(6分)
⑴0.1mol ⑵2mol·L-1
26.(12分)
⑴红色 7.2g
⑵能 其组成为CuSO4 4g、CuO 6g
⑶CuO:4g Cu2O:3.6g
⑷B
说明:由于本人只有试卷,没有参考答案,故答案可能有错误且不够完整,望谅解
|