|
高三总复习专题:化学平衡移动原理及化学平衡常数练习
一、选择题
 1、在一定温度下,可逆反应:ClF(气)+F2(气) ClF3+268KJ 在密闭容器中达到平衡,下列说法中正确的是 1、在一定温度下,可逆反应:ClF(气)+F2(气) ClF3+268KJ 在密闭容器中达到平衡,下列说法中正确的是
(A)温度不变,缩小体积,ClF的转化率增大
(B)温度不变,增大体积,ClF3的产率提高
(C)降低温度,体积不变,F2的转化率提高
(D)升高温度,增大体积,有利于平衡向正反应方向移动
 2、一定量混合气体在密闭容器中发生如下反应:xA(气) yB(气) zC(气),达平衡后测得A气体的浓度为0.50摩/升。恒温下将容器扩大1倍,反应重新平衡,测得A浓度为0.30摩/升。下列叙述中正确的是 2、一定量混合气体在密闭容器中发生如下反应:xA(气) yB(气) zC(气),达平衡后测得A气体的浓度为0.50摩/升。恒温下将容器扩大1倍,反应重新平衡,测得A浓度为0.30摩/升。下列叙述中正确的是
(A)x y>z (B)平衡向右移动
(C)B的转化率提高 (D)C的体积百分含量降低
3. 对已达化学平衡的下列反应: 2X(g)+Y(g) 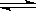 2Z(g), 减小压强时,对反应产生的影响是: 2Z(g), 减小压强时,对反应产生的影响是:
A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C. 正、逆反应速率都减小,平衡向逆反应方向移动
D. 正、逆反应速率都增大,平衡向正反应方向移动
4. 在一个固定体积的密闭容器中,放入3升X(g)和2升Y(g),在一定条件下发生下列反应:
4X(g)+3Y(g) 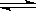 2Q(g)+nR(g) 达到平衡后,容器内温度不变,混合气体的压强比原来增加了5%, 2Q(g)+nR(g) 达到平衡后,容器内温度不变,混合气体的压强比原来增加了5%,
X的浓度减小1/3,则该反应式中的n值是:
A. 3 B. 4 C. 5 D. 6
5. 在已经处于化学平衡状态的体系中,假如下列量发生变化,其中一定能表明平衡移动的是:
A. 反应混和物的浓度 B. 反应物的转化率 C. 正、逆反应速率 D. 反应混和物的压强
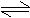 6、在一定条件下PCl5分解反应达到平衡:PCl5(g) PCl3(g) Cl2(g)。下列情况中肯定不会使平衡发生移动的是 6、在一定条件下PCl5分解反应达到平衡:PCl5(g) PCl3(g) Cl2(g)。下列情况中肯定不会使平衡发生移动的是
A、不改变各物质的质量,使容积增至2L。 B、通入N2使容积增至2L,总压强保持不变。
C、保持容积不变,通入N2使总压强增大一倍。D、保持容积不变,通入Cl2使总压强增大一倍。
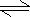 7、体积相同的密闭容器A、B中,保持温度为427K,同时向A、B中分别加入amol和bmolHI气体(a>b),待反应2HI(g) H2(g) I2(g)达到平衡后,下列说法中正确的是 7、体积相同的密闭容器A、B中,保持温度为427K,同时向A、B中分别加入amol和bmolHI气体(a>b),待反应2HI(g) H2(g) I2(g)达到平衡后,下列说法中正确的是
A、达到平衡所需时间tA>tB B、平衡时[I2]A=[I2]B
C、平衡时I2蒸气体积分数A%>B% D、HI的平衡分解率xA=xB
8、下列事实不能应用勒沙特列原理解释的是
(A)使用催化剂可同时提高正逆反应速度 (B)向NH3· H2O中加酸有利于NH4+的增多
(C)密封于烧瓶中的NO2浸入热水后颜色变深 (D)合成NH3在较高温度下进行
9、在A+B(s) 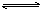 C的反应中,若增大压强或降低温度,B的转化率均增大,则反应体系应是 C的反应中,若增大压强或降低温度,B的转化率均增大,则反应体系应是
(A)A是固体、C是气体,正反应吸热 (B)A是气体、C是液体,正反应放热
(C)A是气体、C是气体,正反应放热 (D)A是气体、C是气体,正反应吸热
10、已达到平衡的可逆反应,再进行降温、加压,则颜色一定会变深的是
   A、2NO2 N2O4,△H< 0 B、2NO2 2NO O2,△H>0 C、H2 Br2 2HBr,△H<0 A、2NO2 N2O4,△H< 0 B、2NO2 2NO O2,△H>0 C、H2 Br2 2HBr,△H<0
  D、2HI H2 I2,△H> 0 E、3NO2 H2O 2HNO3 NO,△<0 D、2HI H2 I2,△H> 0 E、3NO2 H2O 2HNO3 NO,△<0
11、下列数据是一些反应的平衡常数,试判定,表示反应进行得最接近完全的平衡常数是
A、K=1 B、K=10-1 C、K=1010 D、K=10-10
12、关于化学平衡常数K的叙述正确的是
A、K越大,表示化学反应速率越大 B、对任一可逆反应,温度升高,则K值增大。
C、对任一可逆反应,K越大;表示反应物的转化率越大
D、加入催化剂或增大反应物的浓度时,K值就增大
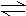 13、在一定条件下,已达平衡的可逆反应:2A(g) B(g) 2C(g),下列说法中正确的是 13、在一定条件下,已达平衡的可逆反应:2A(g) B(g) 2C(g),下列说法中正确的是
A、平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K= 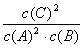
B、改变条件后,该反应的平衡常数K一定不变
C、假如改变压强并加入催化剂,平衡常数会随之变化
D、若平衡时增加A和B的浓度,则平衡常数会减小
 14、CO2和H2的混合气体加热到850℃时,可建立下列平衡:CO2 H2 CO H2O在一定温度下,反应平衡时有90%的氢气变成水,且c(CO2)×c(H2)=c(CO)×c(H2O),则原混合气体中CO2和H2分子数之比是 14、CO2和H2的混合气体加热到850℃时,可建立下列平衡:CO2 H2 CO H2O在一定温度下,反应平衡时有90%的氢气变成水,且c(CO2)×c(H2)=c(CO)×c(H2O),则原混合气体中CO2和H2分子数之比是
A、1:1 B、5:1 C、9:1 D、1:10
 15、在体积固定的密闭容器中进行反应:3X2(g)+Y2(g) 2Z(g),X2、Y2、Z的起始浓度依次为0.3 mol/L,0.1 mol/L,0.2 mol/L;当反应达到平衡时,各物体质的浓度有可能的是 15、在体积固定的密闭容器中进行反应:3X2(g)+Y2(g) 2Z(g),X2、Y2、Z的起始浓度依次为0.3 mol/L,0.1 mol/L,0.2 mol/L;当反应达到平衡时,各物体质的浓度有可能的是
A.c(X2)=0.1 mol/L B.c(Y2)=0.2 mol/L C.c(Z)=0.4 mol/LD.c(X2)=0.5 mol/L
16、一定温度下,在密闭容器中加入H2和I2各0.5mol发生反应:
H2(气)+I2(气)  2HI(气)达到平衡时,生成HI 0.8mol,若其他条件不变,开始充入的H2为2mol,则达到平衡时生成的HI为 2HI(气)达到平衡时,生成HI 0.8mol,若其他条件不变,开始充入的H2为2mol,则达到平衡时生成的HI为
(A)仍为0.8mol (B)1mol (C)大于0.8mol,小于1mol (D)大于1mol
17、反应2A(气) 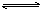 B(气)+xC(气),在一定条件下达到平衡,密闭容器内压强增加了 B(气)+xC(气),在一定条件下达到平衡,密闭容器内压强增加了 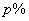 ,测得A的转化率为 ,测得A的转化率为 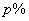 ,则x的值为 ,则x的值为
(A)1 (B)2 (C)3 (D)4
18、在温度、压强不变时,1LNO2高温分解,按2NO2 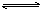 2NO+O2达平衡时,体积变为1.2L,这时NO2的转化率为 2NO+O2达平衡时,体积变为1.2L,这时NO2的转化率为
(A)50% (B)40% (C)20% (D)10%
二、填空题
19、写出下列化学反应的化学平衡常数表达式:
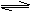 ① ①  K= K=
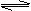 ② ② 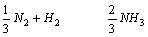 K= K=
 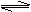 ③3 ③3 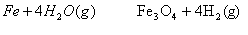 K= K=
20、CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白:
 CO Hb·O2 O2 Hb·CO CO Hb·O2 O2 Hb·CO
实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,也可造成人的智力损伤。抽烟后,测得吸入肺部的空气CO和O2的浓度分别为10-6mol·L-1和10-2mol·L-1,并已知37℃时上述反应的平衡常数K=220,那么,此时Hb•CO的浓度是Hb·O2的浓度的多少倍?
21、(8分)现有反应:CO(气) H2O(气) CO2(气) H2(气) 热量。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K__ ___l (填“大于”、“小于”、或”等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO,3.0molH2O,1.0molCO2和xmolH2,则:
当x=5.0时,上述反应向___________________(填“正反应”或“逆反应”)方向进行。
若要使上述反应开始时向正反应方向进行,则x应满足和条件是________ __________。
(3)在850℃时,若设x=5.0 和x=6.0,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%,b%,则a___ __b(填“大于、小于或等于”)
22. 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) 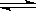 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表: CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表: |
t℃ |
700 |
800 |
830 |
1000 |
1200 | |
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 | |