| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
Ⅲ.数据处理与问题讨论 ①本实验需要的试剂是 ,还缺少的一种仪器是________________。 ②滴定过程中使用pH计将溶液的pH变化情况记录如下表。
| V(NaOH)/mL
| 0.00
| 10.00
| 18.00
| 19.80
| 19.98
| 20.00
| 20.02
| 20.20
| 22.00
| 溶液pH
| 2.88
| 4.70
| 5.70
| 6.74
| 7.74
| 8.72
| 9.70
| 10.70
| 11.70 |
在答应的误差范围(±0.1%)内,pH突变的范围为______,所以可选择_______作指示剂。
③甲同学在处理数据过程中计算得到平均消耗的NaOH溶液的体积为:
V(NaOH)= ![]() =20.20 mL
=20.20 mL
他的计算合理吗?理由是________________________________________________。
④该市售白醋样品中醋酸的物质的量浓度是_____________mol·L-1,样品总酸量为___________g/100mL。
18.钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(FeTiO3)制取TiO2的流程如下:
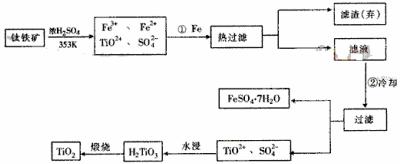
(1) Ti的原子序数为22,Ti位于元素周期表中第 周期,第 族。
(2) 步骤①加Fe的目的是 ;
步骤②冷却的目的是 。
(3) 上述制备TiO2的过程中,可以利用的副产物是 ;考虑成本和废物综合利用因素,废液中应加入 处理。
(4) 由金红石(TiO2)制取单质Ti,涉及到的步骤为:
![]()
已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH= 141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
反应TiCl4+2Mg=2MgCl+Ti 在Ar气氛中进行的理由是 。
四、(本题包括2小题)
19.⑴镁.锌和铝都是活泼金属,镁的氢氧化物只溶于强酸,而锌和铝其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
①写出锌和氢氧化钠溶液反应的化学方程式_________________________________。
②下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是_______________。
a.硫酸铝和氢氧化钠 b.硫酸铝和氨水 c.硫酸锌和氢氧化钠 d.硫酸锌和氨水
⑶写出可溶性铝盐与氨水反应的离子方程式_________________________________。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原_ _。
⑵用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象得出的结论是
(A)实验中发生的反应都是氧化还原反应 (B)铝是一种较活泼的金属
|
铝箔 |
|
红墨水 |
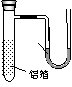 (C)铝与氧气反应放出大量的热量 (D)铝片上生成的白毛是氧化铝和氧化汞的混合物
(C)铝与氧气反应放出大量的热量 (D)铝片上生成的白毛是氧化铝和氧化汞的混合物
20.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:① X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 。
(2)Z2Y2与X2Y反应的化学方程式是 。
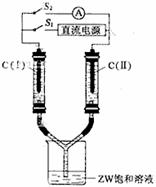 (3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)四周溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是 (填写正极或负极);
C(II)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。
五、推断题
|
B |
|
DD |
|
E |
|
C |
|
G |
|
F |
|
H |
|
I |
|
A |
|
稀盐酸 |
|
稀盐酸 |
|
稀盐酸 |
|
加热 ① |
|
高温 |
|
G H2O2 |
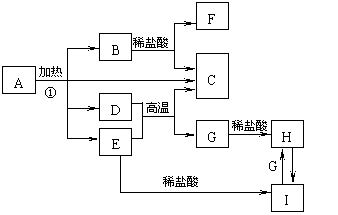 21.化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
21.化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
已知:A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且式量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使苯酚溶液显紫色。
回答下列问题:
(1)C的电子式 。
(2)A的化学式 。
(3)D E→C G的方程式 。
(4)H H2O2→I的离子反应方程式 。
(5)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是 。
六、(本题包含2个小题)
22.为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1) 若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L。
反应的化学方程式是__________________________。
样品中铝的质量是_____________g。
(2) 若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:_____________,氧化铁与铝的质量比是_____________。
(3) 待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c∶b=_____________。
23.钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿吨,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性熟悉。请您对社会实践活动小组感爱好的问题进行计算:
(1)将6.62 g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH 溶液,充分反应后,过滤、洗涤、灼烧得4.80 g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00 t生铁(含铁96%),至少需要这种铁矿石多少吨? (保留两位小数)
(2)取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224 mL(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
实验序号
= 1 \* ROMAN I
= 2 \* ROMAN II
= 3 \* ROMAN III
加入钢样粉末的质量/g
2.812
5.624
8.436
生成气体的体积/L(标准状况)
1.120
2.240
2.800
计算硫酸溶液的物质的量浓度。
③若在实验 = 2 \* ROMAN II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少? (用含m的代数式表示)
模拟卷(一)参考答案
一、 选择题(共8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.A 2.B 3.C 4.A 5.B 6.C 7.D 8.C
二、选择题(共8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。)
9.A 10.B 11.BC 12.C 13.C 14.CD 15.AD 16.BD
三.(本题包括2小题)
17. ⑴用玻棒蘸取食醋滴到pH试纸上,30秒后与比色卡对照
⑵PH计
⑶醋酸是弱电解质,不能完全电离,有醋酸分子。
⑷能 将食醋稀释或用活性炭脱色
⑸Ⅲ
①白醋样品100mL、0.1000 mol·L-1 NaOH标准溶液、蒸馏水、酚酞溶液 锥形瓶
②7.74~9.70 酚酞
③不合理,因为第3组数据明显偏大,不应采用
④1.0 6.0
18. (1) 4; ⅣB
(2) 将Fe3 还原为Fe2 ; 析出(或分离、或得到)FeSO4·7H2O
(3) FeSO4·7H2O; 石灰(或碳酸钙、废碱)
(4) -80 kJ·mol-1 ; 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
四、(本题包括2小题)
19.⑴ Zn+2NaOH=Na2ZnO2+H2↑[或Zn+2NaOH+2H2O=Na2Zn(OH)4+H2↑]
⑵ ①③④
⑶ Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 氢氧化锌溶于过量的氨水
⑷ABC
20.(1)Na2O
(2)2Na2O2+2H2O=4NaOH+O2↑
(3)负极; Cl2+2e-=2Cl-
(4)Cu+H2O2+2H =Cu2 +2H2O
五、推断题
21. (1) ![]()
(2)K3Fe(C2O4)3
(3)3CO Fe2O3===2Fe 3CO2
(4)2Fe2 H2O2 2H =2Fe3 2H2O
(5)因为溶液中的草酸根被高锰酸钾氧化,溶液中的Fe3 与SCN—离子反应。
六、(本题包含2个小题,共14分)
22.⑴2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 9b/11.2
⑵2Al+Fe2O3=2Fe Al2O3 80:27 ⑶2:3
23.(1)6.62 g铁矿石中铁的质量为m(Fe) = 4.80 g× ![]() = 3.36 g,
= 3.36 g,
有: 矿石 ~ 生铁
![]() =
= ![]() ,解得m(矿石) = 1.97 t。
,解得m(矿石) = 1.97 t。
(2)①n(C) = ![]() = 0.010 mol,得m(C) = 0.12 g。
= 0.010 mol,得m(C) = 0.12 g。
n(Fe):n(C) = ![]() :0.01 mol = 50:1。
:0.01 mol = 50:1。
②从表中可知,实验 = 3 \* ROMAN III中的H2SO4完全反应,所以有:n(H2SO4) = n(H2),
即:c(H2SO4)×0.1 L = ![]() ,得c(H2SO4) = 1.25 mol·L-1。
,得c(H2SO4) = 1.25 mol·L-1。
③H2SO4共0.125 mol,设再加入钢样的质量为m时酸反应完,则有:
n(Fe)总= (5.624 g m)× ![]() = n(H2SO4) = 0.125 mol,得m = 1.406 g。
= n(H2SO4) = 0.125 mol,得m = 1.406 g。
a.若加入的钢样粉末过量(m≥1.406 g),H2SO4全反应,则:
m(余固体) = (5.624 g m g)-0.125 mol×56 g·mol-1 = (m-1.376)g。
b.若加入的钢样粉末少量(m≤1.406 g),Fe全溶解,则:
m(余固体) = (5.624 g m g)× ![]() 。
。
| |