| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
(三) 计算:样品中铜的质量分类=___________________(用含W、m1、m2的代数式表示) (五)问题和讨论: 实验完成后,老师评议说:按上述实验设计,即使G中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与G之间加入一个装置。再次实验后,得到了较正确的结果。那么,原来实验所测得的钢的质量分数偏小的原因可能是_______________-,在B与G之间加入的装置可以是____________________,其中盛放的药品是__________________。 29.我国规定饮用水质量标准必须符合下列要求:
| PH值
| 6.5-8.5
| Ca2 ,Mg2 总浓度
| <0.0045mol/L
| 细菌总数
| <100个/mL |
以下是源水处理成自来水的工艺流程示意图
|
|
|
|
|
(1) 源水中含Ca2 、Mg2 、 ![]() 、CL-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_____________
、CL-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_____________
(2) 凝聚剂除去悬浮固体颗粒的过程__________(填写编号,多选倒扣)
①只有物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O常用的凝聚剂,它在水中最终生成___________沉淀。
(3) 通入二氧化碳的目的是_________________和_____________。
(4) 气体A的作用是__________。这种作用是基于气体A和水反应的产物具有______________性。
(5) 下列物质中,______________可以作为气体A的代用品。(填写编号,多选倒扣)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
六、(本题共18分)
30.某烃A,分子量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使石蕊试液变红。
已知
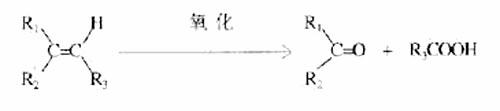
试写出:
(1) A的分子式________________
(2) 化合物A和G的结构简式:
A__________________________
G_________________________
(3)与G同类的同分异构体(含G)可能有________种
31.化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。
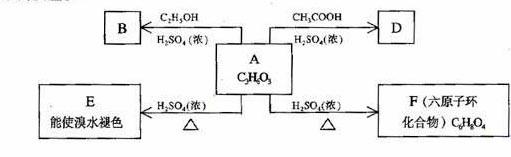
试写出:
化合物的结构简式:A___________________ B_________________
D___________________
化学方程式:A→E_____________________________________
A→F____________________________________
反应类型:A→ E______________,A→F_______________
七、(本题共16分)
32.美籍埃及人泽维尔用激光闪烁照相机拍摄到化学反应中化学键断裂和形成的过程,因而获得1999年诺贝尔化学奖。激光有很多用途,例如波长为10.3微米的红外激光能切断B(CH3)3分子中的一个B—C键,使之与HBr发生取代反应:
B(CH3)3 HBr ![]() B(CH3)2Br CH4
B(CH3)2Br CH4
而利用9.6微米的红外激光却能切断两个B—C键,使之与HBr CH4
而利用9.6微米的红外激光却能切断两个B—C键,并与HBr发生二元取代反应。
(1) 试写出二元取代的代学方程式:
(2)试写出二元取代的化学方程式:
(2) 现用5.6g B(CH3)3和9.72g HBr正好完全反应,则生成物中除了甲烷外,其他两种产物的物质的量之比为多少?
33.某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如下表:
Ⅰ
Ⅱ
Ⅲ
Ⅳ
盐酸液的体积(mL)
30
30
30
30
样品(g)
3.32
4.15
5.81
7.47
二氧化碳的体积(mL)
672
840
896
672
(1) 由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生CO2_________mL(标准状况)。
(2) 另取3.32g天然碱样品于300℃加热分解至完全(300℃时NaCO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
(3) 已知Na2CO3和HCL(aq)的反应分下列两步进行:
Na2CO3 HCL→NaCL NaHCO3
Na2CO3 HCL→NaCL CO2↑ H2O
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式。
全国普通高等学校的招生统一考试
化学试卷答案及评分标准
第Ⅰ卷(共66分)
一、(本题共16分)
1.B 2.C 3.B 4.D 5.C 6.A 7.D 8.B (各2分 共16分)
二、(本题共30分)
9.C 10.A 11.C 12.B 13.D 14.D 15.B 16.A 17.C 18.C(各3分 共30分)
三、(本题共20分)
19.B、C 20.C、D 21.A、D 22.B、C 23.B (各4分,共20分)
第Ⅱ卷 (共84分)
四、(本题共28分,每小题7分)
24.(1)2 4 2 2 1 2 (2分) (注:错1个就不给分)
H2O (1分) (共3分)
(2) ② (1分)
(3)0.2 (1分)
(4)2.63 (2分)
(本题共7分)
25.(1)随着原子序数增大,E值变小 周期性 (各1分 共2分)
(2)①③ (各1分 共2分)
(3)419 738 (填E(钾)、E(镁)也给分)(各1分 共2分)
(4)10号元素是氖。该元素原子的最外层电子排布已达到8电子稳定结构。(注:达到8电子稳定结构也给分) (1分)
(本题共7分)
26.(1)5.5×10-4mol/L-s(注:不写单位扣1分) (2分)
(2)图中实践 (1分)
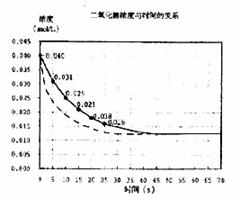 (3)图中虚线 (2分)
(3)图中虚线 (2分)
(4) k= ![]() (2分)
(2分)
(本题共7分)
27.(1)③ (1分)
(2)甲烷(1) ②(2分) (共3分)
(3)③ (2分)
氢气的输送和贮存 (注:其他合理解也给分) (1分)
(本题共7分)
五、(本题共22分)
28.(一)测定铜粉样品中铜的质量分数 (1分)
(三)
B、E中有气泡产生
(1分) (1分)
2H2O2 ![]() 2H2O O2↑ (1分)
2H2O O2↑ (1分)
G中的红褐色粉末变成黑色(1分)
2Cu O2 ![]() 2CuO (1分)
2CuO (1分)
C O2 ![]() CO2
CO2
(四)  (2分)
(2分)
(五)偏小:水蒸汽通过G被D中碱石灰吸收 (1分)
洗气瓶 浓硫酸 (或干燥管 碱石灰) (各1分 共2分)
(本题共12分)
9(1)HC ![]() OH-→C
OH-→C ![]() H2O
H2O
Mg2 2OH-→Mg(OH)2↓
Ca2 HC ![]() OH-→CaCO3↓ h2o (2分)
OH-→CaCO3↓ h2o (2分)
任选其一,其他合理解也给分。 (2分)
(2)③ 胶状Fe(OH)3 (各1分 共2分)
(3)除去Ca2 调节PH值 (各1分 共2分)
(4)杀菌消毒 强氧化 (各1分 共2分)
(5)① ③ (各1分 共2分)
六、(本题共18分)
30.(1)C10H20 (1分)
(2)  (各2分 共4分)
(各2分 共4分)
(3)4种 (1分)
(本题共6分)
31.CH3-CH-COOH CH3-CH-COOC2H5 CH3-COO-CH-COOH
│ │ │
OH OH CH3
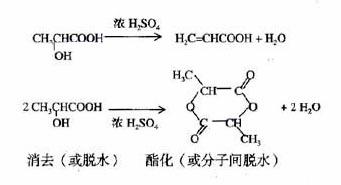 (各2分 共6分)
(各2分 共6分)
(2分)
(2分)
(各1分 共2分)
七.(本题共16分)
32.(1)
B(CH3)3 2HBr ![]() B(CH3)Br2 2CH4 (2分)
B(CH3)Br2 2CH4 (2分)
(2)n[B(CH3)3]= ![]() n(HBr)=
n(HBr)= ![]()
设生成B(CH3)2Br为a mol B(CH3)Br2为b mol
![]()
![]() 则: a b=0.1 a=0.08mol
则: a b=0.1 a=0.08mol
a 2b=0.12 b=0.02mol
∴n[B(CH3)Br]:n[B(CH3)Br2]=4:1 (3分)
(本题共5分)
33.(1) 504 (2分)
(2)由题意可知,天然碱含NaHCO3、Na2CO3
n(NaHCO3)=2n(CO2)=2× ![]() (1分)
(1分)
n(Na2CO3)= ![]() (1分)
(1分)
n(H2O)= 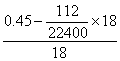 =0.02(mol) (1分)
=0.02(mol) (1分)
∴天然碱组成:2Na2CO3·NaHCO3·2H2O (1分)
(3)2.5 (2分)
(4)0<W≤4.98 V(CO2)=202.4W(mL)
注 V(CO2)= ![]() (1分)
(1分)
4.98≤W≤12.45 V(CO2)=1680-134.9W(mL)
注:V(CO2)=[0.075- ![]() ]×22400(mL)也给分 (1分)
]×22400(mL)也给分 (1分)
12.45≤W V(CO2)=0 (1分)
注:30mL HCl(aq)中所含HCl物质的量: (本题共11分)
n(HCl)= ![]()
CHCL= ![]()
和30mL HCL(aq)完全反应的样品的质量:
![]()
样品中Na2CO3和盐酸反应完全生成NaHCO3时(没有CO2放出时),样品质量:
![]()
| |