| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
下列叙述正确的是 A.L、R的单质与稀盐酸反应速率L<R B.L与T形成的化合物具有两性 C.Q、T两元素的氢化物热稳定性Q<T D.L、Q形成的简单离子核外电子数相等
二、选择题(每小题只有一个选项符合题意,每小题3分,共24分) 9.下列各项中表达正确的是
C.HCl的电子式为: D.NH3的结构式: 10.一定条件下硝酸铵受热分解的化学方程式(未配平)为:NH4NO3→HNO3+N2+H2O,在反应中被还原与被氧化的氮原子数之比为 11.阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是 A.1.0L 1mol/L氨水中,NH3·H2O的分子数为6.02×1023 B.2.4g金属镁变为镁离子时失去的电子数为0.2×6.02×1023 C.白磷分子(P4)呈正四面体结构,31g 白磷中含有P—P键个数为6×6.02×1023 D. 20g 重水(2H216O)中含有的中子数为8×6.02×1023 12.下列离子方程式书写正确的是 A.硫酸铝溶液中滴加过量浓氨水:Al3 4OH—=AlO B.NaHCO3溶液水解:HCO C.浓氢氧化钠溶液吸收少量SO2气体:SO2 2OH—=SO
13.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)四周溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转,说明此时该装置形成了原电池,关于该原电池的叙述正确的是 A. C(I)的电极名称是阴极 B.C(II)的电极名称是负极 C.C(I)的电极反应式是2H 2e—=H2↑ D.C(II)的电极反应式是Cl2+2e-=2Cl- 14. 将0.2mol·L-1HCOOH溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显酸性,下列关系式中正确的是 A.c(HCOOH)<c(HCOO-) B.c(Na+)>c(HCOO-) C.c(HCOOH)-c(HCOO-)=c(OH-) D.c(HCOOH)+c(HCOO-)=0.2mol·L-1 15.下列各组离子水溶液中能大量共存的是 A.I-、ClO-、NO3-、H B.Fe3 、Cu2 、SO42-、Cl- C.H 、K 、AlO2-、HSO3- D.Ca2 、Na 、SO42-、CO32- 16.下表中实验操作能达到实验目的的是
|
| 实验操作
| 实验目的
| A
| 向甲酸钠溶液中加新制的Cu(OH)2并加热
| 确定甲酸钠中含有醛基
| B
| 向苯酚的饱和溶液中滴加稀溴水
| 制备三溴苯酚
| C
| 向酒精和醋酸的混合液中加入金属钠
| 确定酒精中混有醋酸
| D
| 将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液
| 检验水解产物中的溴离子 |
三、(本题包括3小题,共21分)
17.(7分) A、B、C三种元素都是短周期元素,它们的原子核外电子层数相同。A、B元素各自形成的A离子和B离子均和Ne元素的原子电子层结构相同,A元素的氢氧化物比B元素的氢氧化物碱性强。5.8gB的氢氧化物恰好能与100mL 2mol/L盐酸完全反应。C元素的单质化学性质活泼但不能直接和氧气反应。根据上述条件,回答下列问题:
(1)A元素和C元素形成化合物的晶体类型是____▲____晶体。
(2)C元素在元素周期表中的位置是 ▲ ;C的最高价氧化物的分子式为 ▲ 。
(3)B的氢氧化物与盐酸反应的离子方程式: ▲ 。
(4)C元素的单质,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为 ▲ 。
18.(7分)某二元酸(H2A)在水中的电离方程式是:
H2A=H HA- HA- ![]() H A2-
H A2-
回答下列问题:
⑴请判定H2A是强电解质还是弱电解质? ▲ ,理由是 ▲ 。
⑵已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度应 ▲ 0.11 mol·L-1(填“<”,“>”或“=”),理由是: ▲
⑶Na2A溶液显 ▲ (填“酸性”,“中性”或“碱性”)。理由是 ▲ (用离子方程式表示)
⑷H2A溶液和Na2A溶液能否发生反应?能反应的写出离子方程式 ▲ 。
19.(7分)中学化学中几种常见物质的转化关系如下:
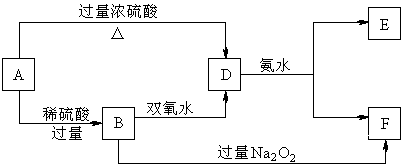
已知A→D的反应必须加热,否则会发生钝化现象。请回答下列问题:
(1)B、D、E的化学式依次为 ▲ 、 ▲ 、 ▲ 。
(2)写出B的酸性溶液与双氧水反应的离子方程式: ▲ 。
(3)写出B和过量过氧化钠反应生成F的化学方程式 ▲ 。
四、(本题包括2小题,共15分)
20.(5分)物质的分离是化学研究中常用的方法,填写下列物质分离时需使用的方法(不必叙述操作细节)。
(1)两种互不相溶的液体的分离 ▲ 。
(2)固体和液体的分离 ▲ 。
(3)含固体溶质的溶液中除去部分溶剂 ▲ 。
(4)胶体中分离出可溶电解质 ▲ 。
(5)几种沸点相差较大的互溶液体的分离 ▲ 。
21.(10分)已知多种重金属化合物能催化H2O2的分解。下图是氨的催化氧化的实验装置。试管中加入过量浓氨水并滴入2ml 5%AgNO3溶液;A为胶头滴管,预先吸有25%的H2O2溶液; B中装有铂石棉催化剂。点燃酒精灯一段时间后,将A中的H2O2溶液慢慢地滴入试管,试管内产生大量气体。不久,锥形瓶C内出现红棕色气体。回答下列问题:
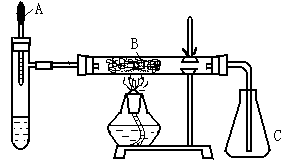
(1)你认为反应中能催化分解H2O2的物质是(写化学式) ▲ 。
(2)试管中产生的气体是 ▲ 。
(3)B中发生反应的化学方程式 ▲ 。
(4)本实验还可以改用其他药品,例如在试管中加固体 ▲ ,胶头
滴管预先吸入液体 ▲ 。
(5)除干燥装置外,此实验装置的缺点是还缺少 ▲ 装置。
五、(本题包括2小题,共12分)
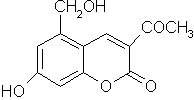 22.(6分)针对齐齐哈尔第二制药有限公司(以下简称齐二药)生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭一事,药品安全问题引起人们的关注。“亮菌甲素”结构简式如右图,是黄色或橙黄色结晶粉末,几乎不溶于水,辅料丙二醇(C3H8O2)溶成针剂用于临床。该药为利胆解痉药,适用于急性胆囊炎、慢性胆囊炎急性发作及慢性浅表性胃炎等。
22.(6分)针对齐齐哈尔第二制药有限公司(以下简称齐二药)生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭一事,药品安全问题引起人们的关注。“亮菌甲素”结构简式如右图,是黄色或橙黄色结晶粉末,几乎不溶于水,辅料丙二醇(C3H8O2)溶成针剂用于临床。该药为利胆解痉药,适用于急性胆囊炎、慢性胆囊炎急性发作及慢性浅表性胃炎等。
(1) 写出“亮菌甲素”的分子式 ▲ 。
(2) 1 mol亮菌甲素最多能和 ▲ mol H2发生反应,该反应类型是 ▲ 反应。
(3) 写出“亮菌甲素”和足量NaOH溶液完全反应的化学反应方程式:
▲ 。
23.(6分)含碳、氢、氧元素的下列有机物分子式通式:
A. ![]() B.
B. ![]() C.
C. ![]()
D. ![]() E.
E. ![]() F.
F. ![]()
(1)若充分燃烧某类有机物,消耗氧气的体积与生成二氧化碳的体积之比为5∶4(相同条件下),则该类有机物分子式通式是上述各式中的 ▲ (填代号)。
(2)若某有机物分子式符合上述C的通式,其相对分子质量为136,写出该有机物的分子式 ▲ ;若该有机物属于酯类且分子中含有苯环.则其可能的同分异构体有 ▲ _种,写出其中不能发生银镜反应的同分异构体的结构简式 ▲ 。
六、(本题包括2小题,共12分)
24.(6分)在一定温度下有甲、乙两容积相等的容器。
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3 a mol。此时,NH3的物质的量分数是 ▲ 。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将 ▲ (选填“增大”、“减小”若“不变”)。
(2)向乙中通入2 mol NH3,欲使反应达到平衡时,各物质的浓度与(1)中第一次平衡时相同,则起始时还需通入 ▲ molN2和 ▲ molH2。
(3)若起始时,向乙中通入6molN2和8molH2,达到平衡时,生成的NH3的物质的量为b mol,则 ![]() ▲
▲ ![]() (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
25.(6分)将5.1 g镁铝合金溶于600 mL 0.5 mol·L-1H ![]() SO
SO ![]() 溶液中,完全溶解后再加入1.0 mol·L-1的NaOH溶液,得到沉淀的质量为13.6 g,继续滴加NaOH溶液时则沉淀会减少。
溶液中,完全溶解后再加入1.0 mol·L-1的NaOH溶液,得到沉淀的质量为13.6 g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入___▲__mLNaOH溶液时,可使溶解在硫酸中的Mg ![]() 和Al
和Al ![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)
参考答案及评分标准
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.B 2.C 3.D 4.C 5.B 6.A 7.C 8.B
二、选择题(每小题只有一个选项符合题意,每小题3分,共24分)
9.D 10.A 11.B 12.C 13.D 14.A 15.B 16.A
三、(本题包括3小题,共21分)
17.(7分) (1)离子(2)第三周期VIIA族 ; Cl2O7(每空1分,共3分)
(3)Mg(OH)2 2H ==Mg2 2H2O (2分)
(4)Cl2 2OH-=2Cl- ClO- H2O (2分)
18.(7分)(1)强电解质;因为H2A的第一步电离是完全的。
(2)<;因H2A第一步电离产生的H ,抑制了HA-的电离。
(3)碱性;A2- H2O ![]() HA- OH-
HA- OH-
(4)H A2-==HA- (答“不反应”或离子方程式不写不给分)
(每空1分)
19.(共7分)(1)FeSO4;Fe2(SO4)3;(NH4)2SO4 (各1分,共3分)
(2)2Fe2++H2O2+2H+=2Fe3++2H2O (2分)
(3)4Na2O2 6H2O 4FeSO4==4Fe(OH)3↓ 4Na2SO4 O2↑(2分) 或写成
2FeSO4 H2SO4 3Na2O2 2H2O==2Fe(OH)3↓ 3Na2SO4 O2↑(2分)
若反应分三步书写:2Na2O2 2H2O==4NaOH O2↑;FeSO4 2NaOH==Fe(OH)2↓ Na2SO4;4Fe(OH)2 O2 2H2O==4Fe(OH)3 全部写正确,同样给分,其中有一个错误就不给分。其它合理的反应过程参照给分。
四、(本题包括2小题,共15分)
20.(5分)(1)分液 (2)过滤 (3)蒸发 (4)渗析 (5)蒸馏(或分馏)
(各1分,错别字不给分)
21.(10分)(1)[Ag(NH3)2] {或[Ag(NH3)2]OH、[Ag(NH3)2]NO3}(2分)
|
(3)4NH3 5O2 4NO 6H2O (2分,无反应条件扣1分)
(4)Na2O2 浓氨水 (各1分,共2分) (5)尾气吸收 (2分)
五、(本题包括2小题,共12分)
22.(6分)(1)C12H10O5(2分)
(2)5 ;加成 (或还原;各1分,共2分)
(3) 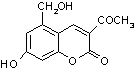 3NaOH
3NaOH ![]()
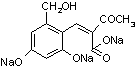 2H2O(2分)
2H2O(2分)
23.(6分)(1)D (2分)
(2) ![]() 6
6 
(各1分,共4分)
六、(本题包括2小题,共12分)
24.(6分)(1) ![]() ×100% ;增大 (2)2;1 (3)< (每小题各2分)
×100% ;增大 (2)2;1 (3)< (每小题各2分)
25.(6分) (1)600 (2分)
(2)据题意,作下图示:
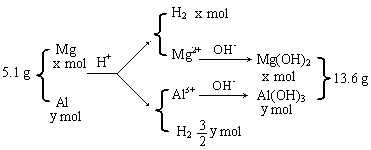
![]()
![]() 列式: 24x 27y=5.1 解得: x=0.1
列式: 24x 27y=5.1 解得: x=0.1
58x 78y=13.6 y=0.1
(3分)
氢气的体积为:(0.1 ![]() ×0.1)×22.4=5.6(L) (1分)
×0.1)×22.4=5.6(L) (1分)
其它合理解法参照给分。
| |