|
苏教版必修1专题2 第二单元课时练习2 碳酸钠的性质与应用
一、选择题
1.不能用来鉴别Na2CO3和NaHCO3的方法是 ( )
A.分别加热 B.加澄清石灰水 C.加稀盐酸 D.加BaCl2
2.关于NaHCO3的性质,下列说法正确的是 ( )
A.和酸反应放出等量的CO2所消耗的酸比Na2CO3少
B.相同温度下溶解度比Na2CO3要大
C.热稳定性比Na2CO3强
D.NaHCO3只能和酸作用不能和碱作用
3.下列关于碳酸钠和碳酸氢钠的比较中,正确的是 ( )
A .二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度
B .二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠的热稳定性
C.二者都能与盐酸反应放出二氧化碳气体,但产气量和反应快慢不同
D .二者在一定的条件下可以相互转化
4.下列说法中不正确的是 ( )
A.Na2CO3 和NaHCO3均可与HCl反应
B.Na2CO3比NaHCO3易溶于水
C.Na2CO3的稳定性比NaHCO3强
D.Na2CO3能与石灰水反应而NaHCO3不反应
5.可以用来断定碳酸氢钠粉末中是否混有碳酸钠的实验方法是 ( )
A.加热时有无色气体放出
B.滴加盐酸时有无气泡放出
C.溶于水后,滴加稀的氯化镁溶液有无白色沉淀生成
D.溶于水后,滴加澄清石灰水,有无白色沉淀生成
6.有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,笫二份先加热使其完全分解再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为 ( )
A.2:1 B.1:1 C.1:2 D.4:2
7.一定温度下,向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3,搅拌后静止,最终所得晶体的质量是 ( )
A.等于1.06g B.大于1.06g而小于2.86g C.等于2.86g D.大于2.86g
二、填空题
8.碳酸钠俗名________或________,是一种________色________体,含10个结晶水的碳酸钠的化学式________________,写出碳酸钠与盐酸反应的离子方程式_______。
9.Na2CO3固体中混有少量NaHCO3,除去杂质的方法是 ,反应方程式为 ;NaHCO3溶液中混有少量Na2CO3,除去杂质的方法是 ,反应的离子方程式为 ;除去CO2气体中少量HCl,所用试剂是 ,反应的离子方程式为 。
10.(8分)有两包白色粉末,只知分别是K2CO3和NaHCO3,请你写出鉴别方法(可以少于2种,也可以多于2种,写出2种方法可得6分,3种以上方法得8分)?
⑴ 。
⑵ 。
⑶ 。
11.工业生产的纯碱中常含有少量的NaCl杂质。某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用下图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数。
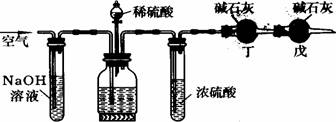
甲 乙 丙
(1)甲装置的作用是 ;丙装置的作用是
(2)乙装置反应前先通数分钟空气的作用是 ,甲装置反应的离子方程式是 。
(3)若去掉丙装置,测得的CO2质量会 (填“偏大”或“偏小”)。
(4)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为w,则Na2CO3质量分数的计算式为 。
三、计算
12.现有Na2CO3和NaHCO3的混合物13.7g,用过量的盐酸处理,共收集到气体6.6g,求混合物中NaHCO3的质量分数。
苏教版必修1专题2 第二单元课时练习2 碳酸钠的性质与应用答案
一、选择题
1.B 2.A 3.BD 4. D 5.C 6.B 7.D
二、填空题
8. 2 NaHCO3 = Na2CO3 CO2↑ H2O 通人过量的CO2
CO32- CO2 H2O= 2HCO-3 ;试剂是 饱和的NaHCO3溶液 ,反应的离子方程式为 HCO-3 H =H2O CO2
10.(1) 加热分解法:取两种少许待检粉末于试管中,分别加热,有CO2气体产生的是NaHCO3。
(2)盐酸产气法:取两种少许待检粉末于试管中,同时分别在两支试管中加入1mL稀盐酸,产气速度快的是NaHCO3。
(3)焰色反应法:取两种粉末进行焰色反应实验,透过钴玻璃能够观察到紫色火焰的是K2CO3 。
11.⑴吸收空气中的二氧化碳;吸收二氧化碳中的水蒸气。
⑵排出装置中的二氧化碳气体;CO2 2OH-==CO32- H2O
⑶偏大 ⑷ 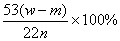
三、计算
12. 61.3%
|