|
高中学生学科素质训练系列试题
高一化学上学期期中测试
[原人教版]
本试题分为第Ⅰ卷和第Ⅱ卷两部分,第Ⅰ卷为选择题,共45分;第Ⅱ卷为非选择题,共55分。满分100分,考试时间为90分钟。
可能用到的相对原子质量:H—1 Cl—35.5 Na—23 O—16 Mn—55
第Ⅰ卷(选择题,共45分)
一、选择题(每题3分,共45分. 每小题只有一个选项符合题意)
1. 苹果汁中含有Fe2+,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生。这说明维生素C具有 ( )
A.还原性 B.氧化性 C.碱性 D.酸性
2.下列各组物质,前者属于电解质,后者属于非电解质的是 ( )
A.NaCl晶体、BaSO4 B.铜、二氧化硫
C.液态的醋酸、酒精 D.熔融的KNO3、硫酸溶液
3.下列电离方程式错误的是 ( )
①NaHCO3 ====Na++H++CO32- ②NaHSO4====Na++H++SO42-
③H2SO4====2H++SO42- ④KClO3====K++Cl-+3O2-
A.①② B.① C.③④ D.①④
4.下列叙述正确的是 ( )
A.含金属元素的离子一定是阳离子
B.金属阳离子被还原不一定得到金属单质
C.强电解质溶液导电性一定强
D.在氧化还原反应中,非金属只做氧化剂
5. 下列各组离子在水溶液中能大量共存,若加入OH-,则有沉淀生成,若加入H+则有气体生成的是 ( )
A.K+、Mg2+、Cl-、HCO3- B.Na+、Ca2+、PO43-、NO3-
C.Ag+、K+、NO3-、Cl- D.K+、NH4+、Cl-、HCO3-
6.根据下列反应判断有关物质还原性由强到弱的顺序是 ( )
H2SO3+I2+H2O====H2SO4+2HI
2FeCl3+2HI====2FeCl2+2HCl+I2
3FeCl2+4HNO3====2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
7.下列离子方程式书写正确的是 ( )
A.稀硫酸滴到铁片上: 2Fe +6 H+=2 Fe3++ 3H2↑
B.硫酸铜溶液与氢氧化钠溶液混合: CuSO4 +2 OH-= Cu(OH)2↓+ SO42-
C.FeCl3溶液与氨水反应: Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
D. 钠与水反应: Na+2H2O=Na++2OH-+H2↑
8.下图分别表示四种错误操作,其中有两个错误的是 ( )
A B C D
9. 在实验室中,当我们用镊子从煤油中取出一小块金属钠,用滤纸将煤油吸干,再用小刀切开。在这一实验过程中肯定不能通过实验和观察得到的钠的物理性质是 ( )
A. 钠在常温下是固体 B.钠的熔点很低
C.钠具有银白色的金属光泽 D.金属钠很软
10.下列反应中,氧化剂与还原剂分子个数比为1∶2的是 ( )
A.2Na2O2+2H2O====4NaOH+O2↑
B.2CH3COOH+Ca(ClO)2====2HClO+(CH3COO)2 Ca
C.I2+2NaClO3====2NaIO3+Cl2
D.4HCl+MnO2==== MnCl2+Cl2↑+2H2O
11.已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3++ 3S↓+7H2O,则M2O7 x-中的M的化合价为
( )
A.+2价 B.+3价 C.+4价 D.+6价
12.对于反应TiCl4+4Na=4NaCl+Ti,下列说法正确的是 ( )
A.该反应说明钠是强还原剂,可用于冶炼金属
B.该反应条件是TiCl4在熔融状态或水溶液中
C.Ti是氧化产物
D.TiCl4是还原剂
13.NaH是一种离子化合物,它跟水反应产生氢气。下列有关NaH的叙述正确的是( )
A.跟水反应时,水作还原剂
B.NaH与水反应后的溶液显酸性
C.NaH中的氢离子最外层有两个电子
D.NaH中的氢离子被还原为H2
14.等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与
反应时间的关系如右图所示,则下列说法正确
的是 ( )
A.三种金属的活动性大小为甲>乙>丙
 B.反应时消耗硫酸的质量一定相同 B.反应时消耗硫酸的质量一定相同
C.三种金属的相对原子质量是甲>乙>丙
D.反应速率最快的是甲,最慢的是乙
15.在ag水中投入bg某固体物质,完全溶解后,所得溶液的溶质的质量分数为 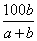 %,该固体是(提示:溶质不一定是所加入的物质) ( ) %,该固体是(提示:溶质不一定是所加入的物质) ( )
A.Na B.Na2O2 C.Na2O D.Na2CO3
第Ⅱ卷(55分)
二、非选择题(55分)
16.(12分)
(1)在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂是_____,氧化产物是________,被氧化与未被氧化的HCl的质量之比为_______,若有7.3gHCl被氧化,产生Cl2的质量为________g。
(2)配平下列化学方程式:
= 1 * GB3 ① Na2O2 + HCl ==== NaCl + H2O + O2↑
= 2 * GB3 ② Fe2+ + ____H+ + NO3- ==== Fe3+ + NO↑ + H2O
17.(10分)实验室由胆矾来制取CuO的基本步骤如下:
①用托盘天来称取一定质量的胆矾,放入研钵中研细后倒入烧杯中,加入一定量的蒸馏水、搅拌,使固体完全溶解。
②向盛有CuSO4溶液的烧杯中滴加NaOH溶液,直到不再产生沉淀。
③用滤纸和漏斗做一个过滤器,过滤并分离烧杯内的液体及沉淀,用少量蒸馏水洗涤沉淀2次—3次。
④把滤纸上的沉淀转移到蒸发皿内加热、搅拌,直到全部变为黑色固体,停止加热。
请回答下列有关问题:
(1)下列有关使用托盘天平的叙述,不正确的是
A.称量前先将托盘天平调零
B.称量时左盘放被称量物,右盘放砝码
C.称量时药品不能用手拿取,砝码可以用手拿取
D.用托盘天平可以准确称量至0.01g
E.称量完毕,应把砝码放回砝码盒中
(2)用托盘天平称量胆矾时读数为5.5g,结果在溶解后发现砝码和固体的位置放反了,则所称得胆矾的实际质量为__________g。
(3)用蒸馏水洗涤Cu(OH)2沉淀的目的是什么?如何判断已洗涤干净?
、
(4)进行过滤操作应选用的一组实验用品是
A.烧杯、酒精灯、试管、铁架台、漏斗
B.漏斗、玻璃棒、烧杯、铁架台、滤纸
C.滤纸、烧杯、试管夹、漏斗、玻璃棒
D.玻璃棒、滤纸、试管、漏斗、铁架台
 18.(10分)某学生设计右图所示装置进行NaHCO3的分解实验,并证实产物中有CO2产生。 18.(10分)某学生设计右图所示装置进行NaHCO3的分解实验,并证实产物中有CO2产生。
①试管中发生的化学反应方程式是:_____________
②指出该学生设计的装置图中的二个错误,并改正
(文字说明即可)。
③为确保实验的成功,停止加热时应该怎样操作,
为什么?
④烧杯中发生反应的离子方程式是:
19.(10分) 现有四种焰色反应均呈黄色的化合物W、X、Y、Z。 其中W、X是厨房常备的两种白色粉末状物质;Y是一种易潮解且腐蚀性极强的白色晶体;Z是淡黄色固体。在一定条件下它们之间可发生下列转化:
① W → X CO2↑ H2O② Z CO2 → X O2③ Z H2O → Y O2↑
④ X Ca(OH)2 → Y CaCO3↓
其中:
(1) W、X的化学式分别是____________和______________。
(2) Z和二氧化碳反应的化学方程式是________________________________。
(3) X和澄清石灰水反应的离子方程式是__________________________________。
20.(5分)有69.3g钾钠合金与足量的水作用,得到氢气2.0g,求该合金中钠和钾的质量。
21.(8分)将一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将放出的气体通入足量的Ca(OH)2饱和溶液中,充分反应后得到的沉淀的质量是1.0g,加热后剩余的固体物质与足量的稀盐酸反应,收集到2.2g气体,计算原固体混合物中Na2CO3与NaHCO3的质量。
参考答案
一、选择题
1. A 2. C 3. D 4. B 5. A 6. A 7. C 8. B 9. B 10. D 11. D 12. A 13. C 14. D 15. D
16.(12分)(1)KMnO4 Cl2 5:3 7.1g (每空2分)
(2) = 1 * GB3 ① 2 Na2O2+ 4 HCl== 4 NaCl + 2 H2O+ 1 O2↑(2分)
= 2 * GB3 ② 3 Fe2+ + 4H+ + 1 NO3-- == 3 Fe3++ 1 NO↑+ 2 H2O(2分) 17.(10分)
(1)CD
(2)4.5
(3)除去附着在Cu(OH)2表面的Na2SO4、NaOH等可溶性杂质。
取最后一次洗涤液几滴,向其中加入CuSO4溶液或Ba(OH)2溶液看是否有沉淀生成,有则没洗涤干净,反之则洗涤干净。
(4)B (每空2分)
18.(10分)①2NaHCO3====Na2CO3+H2O+CO2↑(2分)
②试管内导管太长,伸出活塞即可;试管口应略向上倾斜,“试管夹夹试管太靠近管口”不作为评分要求) (3分)
③先撤除导管,再熄灭酒精灯,否则易使烧杯中的液体倒吸进入热试管使其破裂。(3分)
④Ca2++2OH-+CO2=CaCO3↓+H2O (2分)
19.(8分)
(1) NaHCO3 ,Na2CO3 (4分)
(2) 2Na2O2 2CO2==2Na2CO3 O2 (3分)
(3) Ca2 CO32-==CaCO3↓ (3分)
20.(5分)(其它解法合理也给分)
解:设合金中钠和钾的质量分别是X、Y。
据 2Na 2H2O = 2NaOH H2↑ 2K 2H2O = 2KOH H2↑
46 2 78 2
X  Y Y 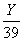
得: X Y =69.3g
 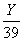 =2.0g =2.0g
解之,得:X=12.5g Y=56.8g
21.(8分)
解:设NaHCO3受热分解产生的CO2质量为X,剩余固体的质量为Y。
由 CO2 Ca(OH)2 = CaCO3↓ H2O
44 100
X 1.0g
得 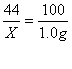 X=0.44g X=0.44g
则 2NaHCO3 = Na2CO3 CO2↑ 2H2O
168 106 44
1.68g 1.06g 0.44g
原混合物中NaHCO3为1.68g,受热分解生成的Na2CO3 为1.06g。
又 Na2CO3 2HCl = 2NaCl CO2↑ H2O
106 44
Y 2.2g
得  Y=5.3g Y=5.3g
故原混合物中Na2CO3的质量为:5.3g-1.06g=4.24g
|