|
高一化学上学期10月份月考
化 学
本试卷分第Ⅰ卷和第Ⅱ卷两部分。第Ⅰ卷为选择题,48分;第Ⅱ卷4页为非选择题,52分;共100分。考试时间为90分。
第Ⅰ卷(选择题 共48分)
可能用到的相对原子质量:Na:23 S:32 O:16 H:1 P:31 Si:28 C:12 N:14
一、选择题(包括24小题,每小题2分,共48分。每小题只有一个选项符合题意。)
1.下列化合物中,不能通过单质间化合直接制取的是 ( )
A.Na2O2 B.CuCl2 C.FeCl2 D.Fe3O4
2.下列分散系中的分散质微粒,粒度属于纳米级(1—100nm)的是 ( )
A.澄清石灰水 B.浑浊的石灰水
C.蛋白质溶液 D.乳浊液
3.下列反应中的酸,既表现出酸性又表现出还原性的是 ( )
A.4HCl(浓) MnO2 MnCl2 Cl2↑ 2H2O
B.Zn 2HCl ZnCl2 H2↑
C.Cu 2H2SO4(浓) CuSO4 2H2O SO2↑
D.2Na2O2 4HCl 4NaCl O2↑ 2H2O
4.要除去FeCl2溶液中少量氯化铁,可行的办法是 ( )
A.通入氯气 B.加入铁粉 C.滴入KSCN D.加入Zn粉
5.下列反应中,一定属于氧化还原反应的是 ( )
A.化合反应 B.分解反应
C.复分解反应 D.4NH3 6NO 5N2 6H2O
6.下列关于胶体的叙述中,不正确的是 ( )
A.向胶体中加入蔗糖溶液,产生聚沉现象
B.向Fe(OH)3胶体中,加入过量稀HCl,先沉淀后溶解
C.用渗析的方法“净化胶体”时,使用的半透膜只让分子、离子通过
D.用电池实验,可能证明Fe(OH)3胶体的微粒带正电
7.钠露置于空气中,可观察到一系列的现象,最终变为 ( )
A.NaOH B.Na2O C.Na2O2 D.Na2CO3
8.已知HClO是弱酸,在水溶液中只部分电离。新制氯水中微粒(离子、分子)的种类有( )
A.8种 B.7种 C.6种 D.5种
9.下列化学家中,属于对近代化学作出重大贡献的是 ( )
A.唐敖庆 B.拉互锡 C.徐光宪 D.杨振宁
10.NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.0.2NA个硫酸分子与19.6磷酸含有不同的氧原子数
B.2.3g钠由原子变成离子时,失去的电子数为0.1NA
C.2g氢气所含的原子数为NA
D.NA个氧分子与NA个氢分子的质量比为8:1
11.在溶液中能共存,加入OH-有沉淀析出,加入H 能放出气体的是 ( )
A.Na 、H 、NO3-、Cl- B.K 、H 、Cl-、SO 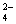
C.Ca2 、NO3-、HCO3-、Cl- D.Fe3 、NH4 、SCN-、Cl-
12.下列说法正确的是 ( )
A.金属单质在反应中只能作还原剂,非金属单质只作氧化剂
B.失电子多的金属还原性强
C.某元素从化合态到游离态,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
13.将适量铁粉投入三氯化铁溶液中,完全反应后,溶液中的Fe2 和Fe3 浓度相等,则已反应的Fe3 和未反应的Fe3 的物质的量之比是 ( )
A.2:3 B.3:2 C.1:2 D.1:1
14.下列物质在空气中变质时,没有氧化还原反应发生的是 ( )
A.氯水 B.氢氧化亚铁 C.Na2O D.Na2O2
15.关于1mol·1-1的Na2SO4溶液的叙述正确的是 ( )
A.溶液中含1molNa2SO4
B.Na 的浓度为1mol·1-1
C.配制时,将1molNa2SO4溶于1L水中
D.将322gNa2SO4·10H2O溶于少量水后再稀释成1000mL,即配制成相应溶液
16.在KClO3 6HCl KCl 3Cl2↑ 3H2O中,被氧化与被还原的氯原子个数比为( )
A.1:6 B.6:1 C.1:5 D.5:1
17.质量相同的下列物质,含分子数最多的是 ( )
A.O2 B.CO C.NH3 D.CH4
18.下列物质不具有漂白性的是 ( )
A.盐酸 B.Ca(ClO)2 C.Na2O2 D.NaClO
19.研究物质性质的基本程序,一般分为四大步,其中第二步是 ( )
A.实验和观察 B.观察物质的外观性质
C.解释及结论 D.预测物质的性质
20.下列既有氧化性,又有还原性的是 ( )
A.Cl- B.Fe2 C.H D.Cu2
21.下列实验现象描述正确的是 ( )
A.Na2O2投入少量酚酞试液中,溶液只变红色
B.将Cl2不断通入紫色石蕊试液中,溶液先变红色,再褪为无色
C.FeCl3溶液中滴加KSCN溶液,有红色沉淀生成
D.Na投入CuSO4溶液中,有红色单质铜生成
22.下列离子方程式正确的是 ( )
A.碳酸钙与盐酸反应: CaCO3 2H
B.铁和稀H2SO4反应 2Fe 6H
C.稀H2SO4与Ba(OH)2混合 H OH- H2O
D.Na与水反应 Na 2H2O Na 2OH- H2↑
23.下列物质在一定条件下能与铜反应的有 ( )
①Cl2 ②浓H2SO4 ③FeCl3 ④AgNO3 ⑤FeCl2
A.①③⑤ B.①③④ C.①②③④ D.①②③④⑤
24.氢化钙可作为生氢剂,化学方程式是CaH2 2H2O Ca(OH2) 2H2↑,下列有关叙述正确的是 ( )
A.氢化钙被还原 B.水既是氧化剂,又是还原剂
C.H2既是氧化产物,也是还原产物 D.H2O发生氧化反应
第Ⅱ卷(非选择题 共52分)
25.(8分)用滴管将新制的饱和氯水逐滴滴入含有酚酞的NaOH溶液中,直至红色褪去,试回答下列问题:
(1)产生上述现象的原因可能有两种(简要文字说明)
①是由于 (2分)
②是由于 (2分)
(2)请设计实验,证明是哪一种原因产生的褪色现象:
26.(8分)实验室配制0.5mol·L-1的NaOH溶液500mL,有以下仪器:
①烧杯 ②胶头滴管 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒
⑥托盘天平(带砝码) ⑦酒精灯
(1)配制时,必须使用的仪器有 (填代号)
(2)该实验两次用到玻璃棒,其作用分别是 、
(3)配制时一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④转移 ⑤洗涤
⑥定容 ⑦摇匀(两次分别排序) ⑧冷却
其正确的操作顺序为②①③
三、(本题包括3个小题,共23分)
27.(8分)书写下列反应的离子方程式
(1)Cl2与NaOH溶液的反应
(2)CuSO4溶液与Ba(OH)2溶液反应
(3)稀H2SO4与KOH溶液反应
(4)Na2CO3溶液与BaCl2溶液反应
28.(6分)制造SiC的化学方程式是:SiO2 3C SiC 2CO↑,按下列要求回答有关问题:
(1)指出氧化剂 (1分),还原剂 (1分)
(2)标出电子转移的方向和数目(要求重新抄写方程式并标出电子转移)
(2分)
(3)制备20gSiC时,电子转移 mol(1分),消耗SiO2 g(1分)
29.(9分)下列框图中的物质中B、C、D为单质,其余为化合物(或其水溶液)
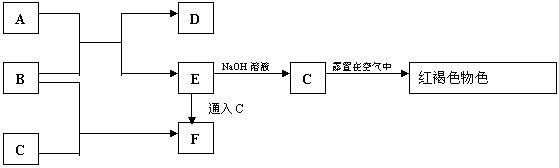
已知A与AgNO3反应生成白色沉淀,C与D反应后的物质溶于水得到A,试回答下列问题:
(1)框图转化中,发生的氧化还原反应有 个(2分)(用A、B、C等回答)
A.2 B.3 C.4 D.5
(2)写出下列物质的化学式:
A物质 (1分) B物质 (1分) C物质 (1分)
(3)G到H的转化过程中有关的现象 (2分)
(4)E中通入C,可以得到F,写出溶液中发生离子反应的方程式
(2分)
四、(本题包括两个小题,共13分)
30.(6分)100mL98%的浓H2SO4,其密度为1.84g·cm-3。求该浓H2SO4的物质的量浓度。
31.(7分)将4.6gNa投入到95.6gH2O中,充分反应后得NaOH溶液。试回答下列问题:
(1)该溶液中含有NaOH物质的量是多少?
(2)求该溶液的质量分数。
(3)能否求出该溶液的物质的量浓度?若能求出物质的量浓度,则求解;若不能,试回答至少还应知道什么数据?
参考答案
一、选择题(包括24小题,每小题2分,共48分。每小题只有一个选项符合题意) |
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 | |
答案 |
C |
C |
A |
B |
D |
A |
D |
B |
B |
B |
C |
D |
A |
C |
D | |
题号 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
|
|
|
|
|
| |
答案 |
D |
D |
A |
D |
B |
B |
A |
C |
C |
|
|
|
|
|
| |