| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
16.把3.6g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加为( ) A 2.1g B 3.6g C 7.2g D 无法确定 17.吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是( ) A 作还原剂 B 作氧化剂 C 既作氧化剂又作还原剂 D 既不作氧化剂又不作还原剂 18.一定量的浓硝酸与过量的铜充分反应,生成的气体是 A 只有NO2 B 只有NO C NO2和NO D NO2和H2 19.在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器内,充分反应后,容器内残留 EQ \F(m,2) 体积的气体,该气体与空气接触后变为红棕色。则m的n比值为() A 3:2 B 2:3 C 8:3 D 3:8 20.将铜粉放入稀硫酸中,加热无明显现象发生。但加入某盐后,发现铜粉质量逐渐减少,则该盐可能是( ) A Fe2(SO4)3 B ZnSO4 C KNO3 D NaCl 第二部分非选择题(50分) 一、选择题
| 题号
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 9
| 10
| 答案
|
|
|
|
|
|
|
|
|
|
| 题号
| 11
| 12
| 13
| 14
| 15
| 16
| 17
| 18
| 19
| 20
| 答案
|
|
|
|
|
|
|
|
|
| |
二、本题包括4小题,共41分
21.(8分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
|
图1 图2 |
|
氨气 |
|
氨气 |
|
水 |
|
水 |
|
水 |
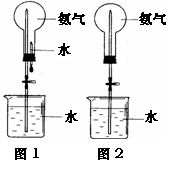 22.(10分) 用右图装置进行喷泉实验(图中夹持装置均已略去)。
22.(10分) 用右图装置进行喷泉实验(图中夹持装置均已略去)。
(1)若用图1装置进行喷泉实验,上部烧瓶已装满干
燥的氨气,引发水上喷的操作是
该实验的原理是
(2)若用图2的装置,请举一例说明引发喷泉的方法。
(3)若用同一烧瓶分别充满如下气体:① HCl ② NH3 ③ NO2进行喷泉实验,实验后烧瓶内溶液液面的高度关系为 (用序号和“>,<或=”表示,下同),所得溶液物质的量浓度大小关系为 。
23.(11分)有两个实验小组的同学用如下图所示的装置进行实验,来探究过氧化钠与二氧化硫的反应
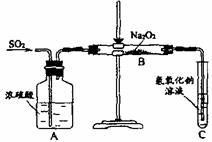
请回答下列问题:
(1)装置C中氢氧化钠溶液的作用是
(2)甲组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3
(3)乙组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
|
白色 沉淀 |

|
将B中反应后的固体溶解于水 |

|
BaCl2溶液 |
|
稀硝酸 |
|
仍有部分白色沉淀不溶解,证明有Na2SO4生成 |

上述方案是否合理? 。请简要说明两点理由:
① ;② 。
24.(12分)现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
|
|
|
![]()
![]()
![]()
![]()
![]()
![]() ②
②
|
|
|
![]()
![]()
![]()
![]() ⑥ ⑤
⑥ ⑤
![]()
![]()
|
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A 、 B 、 C 、
F 、 H 、 乙
(2)写出下列反应化学方程式:
反应①
反应⑤
反应⑥
三、本题包括1小题,共9分
25.(9分)使一定质量的锌与100mL18.5mol/L浓硫酸充分反应。
(1)若锌完全溶解,只生成SO2气体,其体积在标准状况下为3. 36L,求:所得溶液中硫酸锌的物质的量浓度(假设反应前后溶液体积保持不变)。
(2)若锌完全溶解,同时生成标准状况下混合气体为33.6L,并将反应后的溶液稀释至1L,测得溶液中c(H )为0.100mol/L,求混合气体中各组分的体积比。
淮安中学2005年第一学期高一化学试卷(必修1)【人教版】
参 考 答 案
第一部分选择题(70分)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
D
D
A
C
B
B
C
D
B
题号
11
12
13
14
15
16
17
18
19
20
答案
AD
BD
B
A
AB
B
A
C
C
AC
第二部分非选择题(50分)
二、本题包括4小题,共41分
21.(1)2Cl2 2 Ca(OH)2 == Ca(ClO)2 CaCl2 2H2O (2分)
(2)Ca(ClO)2 (2分)
(3)Ca(ClO)2 CO2 H2O == CaCO3↓ 2 HClO (2分)
(4) (1) (2分)
22(1)打开止水夹,挤出胶头滴管中的水。 (2分)
氨气极易溶解于水,致使烧瓶内气体压强迅速减小。 (2分)
(2)打开夹子,用手(或热毛巾等)将烧瓶捂热 (2分)
(3)①=②>③ ①=②=③ (4分)
23.(11分)(1)吸收二氧化硫气体 (2分)
(2).2Na2O2 2SO2 =4Na2SO3 O2↑。取白色固体,加入稀硫酸,产生能使品红溶液褪色的气体。 (4分)
(3)不合理。 ①稀硝酸能使亚硫酸钡转化为硫酸钡。②若反应后残留过氧化钠,它溶于水后能将SO32-转化为SO42-。 (5分)
24.(1)A:Na B:Al C:Fe F:FeCl2 H:Fe(OH)3 乙:Cl2 (各1分,共6分)
(2)反应①:2Na 2H2O == 2NaOH H2↑ (2分)
反应⑤:2FeCl2 Cl2 == 2FeCl3 (2分)
反应⑥:FeCl3 3NaOH == Fe(OH)3↓ 3NaCl (2分)
三、本题包括1小题,共9分
25.(1)Zn 2H2SO4(浓) ![]() ZnSO4 SO2↑ H2O
ZnSO4 SO2↑ H2O
1mol 22.4L
n(ZnSO4) 3.36L
则X n(ZnSO4)=0.150mol, c(ZnSO4)=1.50mol·L-1
(2)据题意:反应后c(H2SO4)为0.0500mol·L-1,n(H2SO4)为0.0500mol
Zn 2H2SO4(浓) ![]() ZnSO4 SO2↑ H2O
ZnSO4 SO2↑ H2O
2n(SO2) n(SO2)
Zn H2SO4(稀)=ZnSO4 H2↑
n(H2) n(H2)
![]() 2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1
2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1
n(SO2) n(H2)= EQ \F(33.6L,22.4L·mol-1)
解得: n(SO2)=0.300mol(6分) n(H2)=1.20mol
则:V(SO2)∶V(H2)=0.300mol∶1.20mol=1∶4
| |