| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
① 通过上述信息和表中的数据分析:为什么锂原子失去核外第二个电子时所需的 能量要远远大于失去第一个电子所需的能量: ; ②在一定条件下,表中X可能与氢气反应的化学方程式是 ; ③Y元素常见的化合价可能是 。 30.铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它氧化性比高锰酸钾更强,本身在反应中被还原为Fe3 离子。制取铁酸钠的程式为: Fe(NO3) NaOH Cl2─Na2FeO4 NaNO3 NaCl H2O ,则反应中 元素被氧化。
五、推断题(本题共1小题,共8分) 31.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图所示的物质之间的变化: 据此判断:
(1)固体B所含物质的化学式为______________; (2)固体E所含物质的化学式为______________; (3)反应①的离子方程式为____________ 。 六、计算题(本题共2小题,共16分) 32.将50mL 0.1mol/LBaCl2溶液与100mL0.75mol/L H2SO4溶液混合,求: (1)反应产生沉淀的质量是 g;(保留2位有效数字) (2)若不考虑溶液体积的变化,则反应后溶液的C(H+)为 。
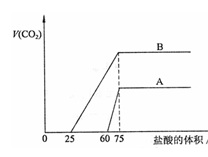 33.取等物质的量浓度的NaOH溶液两份A 33.取等物质的量浓度的NaOH溶液两份A
和B,每份50mL,向其中各通入一定量的CO2, 然后各取溶液10mL,分别将其稀释为100mL, 分别向稀释后的溶液中逐滴加入0.1mol/L的 盐酸,标准状况下产生CO2气体体积与所加盐 酸体积之间的关系如下图所示,试回答下列问题: (1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为) , ,两种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。 (2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为 , ,两种溶质物质的量之比为 ;加盐酸后产生CO2体积最大值 mL。 (3)通过计算求NaOH溶液的物质的量浓度。
答案及评分标准 一、二、选择题(50分)
第Ⅱ卷(共50分) 三、实验题(本题包括2小题,共14分) 26.(1)下列实验操作正确的是 A、B 。 A、用酸式滴定管量取25.12mL的KMnO4溶液 B、用10mL量筒量取8.5mL蒸馏水 C、用pH试纸测定氯水的pH值为3.3 D、将一张湿润的蓝色石蕊试纸投入盛有Cl2的集气瓶中,试纸最终将变红 E、用坩埚加热硫酸铜溶液制取胆矾晶体 (2)下面a—f是中学生实验中常见的几种仪器(填写编号,多选倒扣分): (a)量筒 (b)容量瓶 (c)普通试管 (d)圆底烧瓶 (e)温度计 (f)天平 (1)其中要标示仪器具体使用温度的是(不考虑温度计) a、b ; (2)可用作反应器并能进行加热的是 c、d 。 27.现有一定量含有Na2O杂质的Na2O2试样。请从下图中选用适当的实验装置,请设计一个最简单的实验,测定Na2O2试样的纯度。 (可供选择的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水)。
请填写下列空白: (1)写出实验中Na2O和Na2O2分别发生反应的化学方程式。 Na2O+H2O=2NaOH 、 2Na2O2+2H2O=4NaOH+O2↑ ; (2)应选用的装置是(只要求写出图中装置的标号) ⑤①④ ; (3)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略). GABF 。 四、简答题(本题包括4小题,共12分) 28.含有一定量CH3COONa和CH3COOH的水溶液称作“缓冲溶液”,在该溶液中加入少量的强酸或强碱时,溶液的pH几乎不变,这可由下列离子方程式来说明: 加入酸时CH3COO- H =CH3COOH;加入碱时CH3COOH OH-= CH3COO- H2O, 由于CH3COOH和CH3COO-的大量存在,溶液中的c(H )与c(OH-)基本保持不变。 一定量的H2S和NaHS的溶液也具有缓冲作用,写出在此溶液中加入少量强酸或强碱时发生的离子反应方程式: 加入酸时 HS- H+=H2S ; 加入碱时 H2S OH-=HS-+H2O 。 29.化学反应中,如果给原子核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:原子核对核外电子的吸引力;形成稳定结构的倾向。下表是一些周期表中1-18号元素的气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
| 锂
| X
| Y
| 失去第一个电子
| 519
| 502
| 580
| 失去第二个电子
| 7296
| 4570
| 1820
| 失去第三个电子
| 11799
| 6920
| 2750
| 失去第四个电子
|
| 9550
| 11600 |
② 通过上述信息和表中的数据分析:为什么锂原子失去核外第二个电子时所需的
能量要远远大于失去第一个电子所需的能量:锂失去第一个电子后达稳定结构;
②在一定条件下,表中X可能与氢气反应的化学方程式是 2X+H2=2XH ;
③Y元素常见的化合价可能是 +3 。
30.铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它氧化性比高锰酸钾更强,本身在反应中被还原为Fe3 离子。制取铁酸钠的程式为:
Fe(NO3)3 NaOH Cl2─Na2FeO4 NaNO3 NaCl H2O ,则反应中 Fe 元素被氧化。
五、推断题(本题共1小题,共8分)
31.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图所示的物质之间的变化:
据此判断:
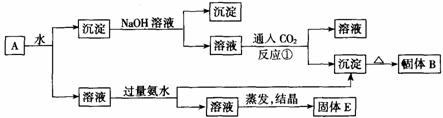
(1)固体B所含物质的化学式为__Al2O3_____;
(2)固体E所含物质的化学式为_K2SO4与(NH4)2SO4___________;
(3)反应①的离子方程式为__ Al O2-+CO2+2H2O=Al(OH)3↓+HCO3- 。
六、计算题(本题共2小题,共16分)
32.将50mL 0.1mol/LBaCl2溶液与100mL0.75mol/L H2SO4溶液混合,求:
(1)反应产生沉淀的质量是 1.2 g;(保留2位有效数字)
(2)若不考虑溶液体积的变化,则反应后溶液的C(H+)为 1. 0mol/L 。
 33.取等物质的量浓度的NaOH溶液两份A
33.取等物质的量浓度的NaOH溶液两份A
和B,每份50mL,向其中各通入一定量的CO2,
然后各取溶液10mL,分别将其稀释为100mL,
分别向稀释后的溶液中逐滴加入0.1mol/L的
盐酸,标准状况下产生CO2气体体积与所加盐
酸体积之间的关系如下图所示,试回答下列问题:
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为NaOH ,Na2CO3 ,两种溶质的物质的量之比为3:1;加盐酸后产生CO2体积的最大值为 33.6 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为 Na2CO3 ,NaHCO3 ,两种溶质物质的量之比为 1:1 ;加盐酸后产生CO2体积最大值 112 mL。
(3)通过计算求NaOH溶液的物质的量浓度。
解析:生成二氧化碳最多时,溶液中只有NaCl
故0.05C(NaOH)×1/5=0.075×0.1
C(NaOH)=0.75mol/L
| |