|
高一上学期月考试化学卷
考试时间:100分钟 满分100分
可能用到的相对原子质量:O- 16 S - 32 N - 14 H - 1
一、选择题(每小题只有一个选项是正确的,请将正确答案填在答题卡的相应位置,每小题3分,共48分)
1.下列反应一定属于氧化还原反应的是 ( C )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
2.下列叙述正确的是 ( B )
A.氧化还原反应的本质是化合价发生变化
B.有单质产生的分解反应一定是氧化还原反应
C.氧化剂在同一反应中既可以是反应物,也可以是生成物
D.还原剂在反应中发生还原反应
3.某元素在化学反应中由化合态变为游离态,则该元素 ( C )
A.一定被氧化 B.一定被还原 C.既可能被氧化,也可能被还原 D.以上都不是
4.下列叙述中,正确的是 ( D )
A、含金属元素的离子一定是阳离子
B、在氧化还原反应中,非金属单质一定是还原剂
C、有单质参与的反应一定是氧化还原反应
D、金属阳离子被还原不一定得到金属单质
5.下列关于氧化还原反应说法正确的是 ( C )
A.肯定一种元素被氧化,另一种元素被还原
B.某元素原子在反应中失去了电子,该元素一定被还原
C.在反应中不一定所有元素的化合价都发生变化
D.在氧化还原反应中非金属单质一定是氧化剂
6.下列反应中,不是氧化还原反应的是 ( A )
①H2 Cl2  2HCl ②Na2CO3 2HCl==2NaCl H2O CO2↑ 2HCl ②Na2CO3 2HCl==2NaCl H2O CO2↑
③2H2O 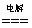 2H2↑ O2↑ 2H2↑ O2↑
④CuO 2HNO3==Cu(NO3)2 H2O ⑤2HgO  2Hg O2↑ 2Hg O2↑
A. ②④ B. ①③ C. ①②③ D. ④⑤
7.在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是 ( D )
A. 2F2 2H2O==4HF O2 B. C H2O  CO H2 CO H2
C. 2Na 2H2O==2NaOH H2↑ D. Cl2 H2O==HCl HClO
8.下列变化需加入还原剂的是 ( B )
A. HCO3-→CO2 B. MnO4-→Mn2 C. FeO→Fe3O4 D. H3AlO3→HAlO2
9. P单质在下列反应中4P 3KOH 3 H2O=3KH2PO2 P H3的变化是 ( C )
A.被氧化 B.被还原 C.既被氧化又被还原 D.既未被氧化又未被还原
10.在H2SO3 2 H2S=3 H2O 3S反应中,被氧化与被还原元素的质量比为 ( B )
A.1:1 B.2:1 C.1:2 D.3:2
11.已知有如下反应:①2BrO3- Cl2==Br2 2ClO3-,②ClO3- 5Cl- 6H ==3Cl2 3H2O,
③2FeCl3 2KI==2FeCl2 2KCl I2,④2FeCl2 Cl2==2FeCl3。
下列各微粒氧化能力由强到弱的顺序正确的是 ( C )
A. ClO3->BrO3->Cl2>Fe3 >I2 B. BrO3->Cl2>ClO3->I2>Fe3
C. BrO3->ClO3->Cl2>Fe3 >I2 D. BrO3->ClO3->Fe3 >Cl2>I2
12.在反应HgS O2==Hg SO2中,氧化剂和还原产物分别是 ( D )
A. O2 Hg B. HgS Hg
C. O2 Hg、SO2 D. Cl2、O2 Hg、SO2
13.用下列方法:①KMnO4受热分解 ②KClO3受热分解(用MnO2作催化剂)
③2H2O2  2H2O O2↑ ④2Na2O2 2H2O==4NaOH O2↑, 2H2O O2↑ ④2Na2O2 2H2O==4NaOH O2↑,
若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是 ( D )
A. 3:2:1:4 B. 1:1:1:1 C. 1:2:1:2 D. 2:2:1:1
14.单质X和Y相互反应生成X2 Y2-。现有下列叙述:①X被氧化、②X是氧化剂、③X具有氧化性、④Y2-是还原产物、⑤Y2-具有还原性、⑥X2 具有氧化性、⑦Y的氧化性比X2 的氧化性强,其中正确的是 (B )
A. ①②③④ B. ①④⑤⑥⑦ C. ②③④ D. ①③④⑤
15.根据下列反应判断有关物质还原性由强到弱的顺序是 ( A )
H2SO3 I2 H2O==2HI H2SO4 2FeCl3 2HI==2FeCl2 2HCl I2
3FeCl2 4HNO3==2FeCl3 NO↑ 2H2O Fe(NO3)3
A. H2SO3>I->Fe2 >NO B. I->Fe2 >H2SO3>NO
C. Fe2 >I->H2SO3>NO D. NO>Fe2 >H2SO3>I-
16. 今有下列三个氧化还原反应:
①2FeCl3 2KI==2FeCl2 2KCl I2 ②2FeCl2 Cl2==2FeCl3
③2KMnO4 16HCl==2KCl 2MnCl2 8H2O 5Cl2↑
若某溶液中有Fe2 和I-共存,要氧化除去I-而又不影响Fe2 和Cl-,可加入的试剂是 ( C )
A. Cl2 B. KMnO4 C. FeCl3 D. HCl
二、填空题
17.(16分)在反应 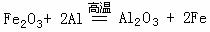 中,______元素的化合价升高,该元素的原子______电子,被________;______元素的化合价降低,该元素的原子______电子,被_________;该反应中,___________是氧化剂,___________是氧化产物。 中,______元素的化合价升高,该元素的原子______电子,被________;______元素的化合价降低,该元素的原子______电子,被_________;该反应中,___________是氧化剂,___________是氧化产物。
18.(12分)配平下列氧化还原反应方程式,回答有关问题.
(1) Cl2 KOH → KCl KClO3 H2O
氧化剂 ,还原剂是 ;
(2) KClO3 HCl → Cl2 H2O KCl
HCl的作用是 ,被还原的元素是 .
19.(6分)一些酸在反应中可以表现出多种性质,如:MnO2 4HCl(浓) == MnCl2 Cl2↑ 2H2O中的HCl既表现出酸性又表现出还原性,分析下列反应中酸的作用.
(1) NaOH HCl==NaCl H2O
____________________;
(2)C 2 H2SO4 == CO2↑ 2 SO2↑ 2H2O
_____________________;
(3)Cu 4HNO3 (浓)==Cu(NO3)2 2 NO2↑ 2H2O
______________________。
20.(12分) 写出符合下列条件的化学反应方程式,是氧化还原反应的标出电子转移的方向和数目,指出还原剂和还原产物。
1.有H2O生成的化合反应 2.有H2O生成的分解反应
3.把Cu片插入硝酸银溶液中 4.有O2生成的分解反应
5.有水H2O生成的置换反应 6.不是四种基本反应类型的氧化还原反应
三.分析计算
21.(6分)日常生活中涉及的许多化学反应都是氧化还原反应。如钢铁生锈,食物的腐败,化石燃料的燃烧等等。某硫酸化工厂煅烧150吨含FeS280%的黄铁矿,已知反应为:
FeS2 O2 → Fe2O3 SO2。 试回答下列问题
(1) 标明元素化合价的变化情况,并根据元素化合价变化情况,指出该化工反应中的氧化剂和氧化产物是什么?
(2) 利用氧化还原反应中氧化剂还原剂得失电子相等的原理配平上述反应方程式。并根据你配平的情况,计算理论上可生产多少SO2气体。

高2011级月考试题化学卷答题卡
一 选择题(共48分)
|
选项 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
答案 |
|
|
|
|
|
|
|
|
|
选项 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
答案 |
|
|
|
|
|
|
|
|
二17.(16分) ______,______电子,被________;______元素的化合价降低,原子______电子,被_________;___________是氧化剂,___________是氧化产物。
18.(12分)(1) Cl2 KOH → KCl KClO3 H2O
氧化剂 ,还原剂是 ;
(2) KClO3 HCl → Cl2 H2O KCl
HCl的作用是 ,被还原的元素是 .
19.(6分)(1) ;
(2) ;
(3) 。
20.(12分)(1)方程式
还原剂 还原产物
(2)方程式
还原剂 还原产物
(3)方程式
还原剂 还原产物
(4)方程式
还原剂 还原产物
(5)方程式
还原剂 还原产物
(6)方程式
还原剂 还原产物
21.(每小题各3分)(1)化合价变化情况: FeS2 O2 → Fe2O3 SO2(标出化合价发生变化的元素)
氧化剂 氧化产物 。
(3) 配平并计算:
FeS2 O2 → Fe2O3 SO2
参考答案:
一
|
选项 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
答案 |
C |
B |
C |
D |
C |
A |
D |
B |
|
选项 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
答案 |
C |
B |
C |
D |
D |
B |
A |
C |
二略
|