|
高一化学上册定时练习题
姓名: 学号:
1.氢气是一种绿色能源,科学家们最近研制出利用太阳能产生激光,再用激光分解海水得到氢气的新技术,其中海水分解可以用化学方程式表示为:2H2O 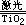 2H2↑ O2↑,据此下列说法不正确的是 ( ) 2H2↑ O2↑,据此下列说法不正确的是 ( )
A.TiO2在反应中作催化剂 B.水分解不产生污染物
C.TiO2在反应中作氧化剂 D.该技术可以将太阳能转化为氢能
2.下列各组离子中,因发生氧化还原反应而不能大量共存的是 ( )
A.Fe3 、H 、SO42—、ClO— B.Fe3 、Fe2 、SO42—、NO3—
C.Al3 、Na 、SO42—、CO32— D.K 、H 、Cl—、MnO4—
3.“神舟五号”载人飞船的成功发射与回收,表明我国的载人航天技术已经达到了国际领先水平。在飞船的火箭推进器中常装有液态肼(用A表示)和过氧化氢(H2O2),它们混合时的反应方程式为:2H2O2 A=N2 4H2O,则肼(A)的化学式为 ( )
A.N2H2 B.N2H4 C.NH2 D.N2H4O2
4.下列反应能用离子方程式H+ OH―=H2O表示的是 ( )
A.氢氧化铜与盐酸 B.氧化钙与盐酸 C.氢氧化钠与醋酸 D.氢氧化钠与稀硫酸
5.工业上制造金刚砂(SiC)的化学方程式如下:SiO2 3C 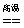 SiC 2CO↑,在这个氧化还原反应中,氧化剂与还原剂物质的量之比是 ( ) SiC 2CO↑,在这个氧化还原反应中,氧化剂与还原剂物质的量之比是 ( )
A.2 :1 B.1 :2 C.5 :3 D.3 :5
6.根据下列反应判断有关物质还原性由强到弱的顺序是 ( )
H2SO3 I2 H2O===2HI H2SO4 2FeCl3 2HI===2FeCl2 2HCl I2 3FeCl2 4HNO3====2FeCl3 NO↑ 2H2O Fe(NO3)3
A. H2SO3>I->Fe2 >NO B. I->Fe2 >H2SO3>NO
C. Fe2 >I->H2SO3>NO D. NO>Fe2 >H2SO3>I-
7.氧化铁和氧化铜混合物mg,加3mol.L-1盐酸溶液100ml,恰好完全溶解,若mg的该混合物在过量氢气流中加热充分反应,冷却后剩余固体质量为 ( )
A.(m -1.6)g B.(m -2.4)g C.(m -3.2)g D.无法确定
8.列离子方程式书写正确的是 ( )
A.将氧化铜与盐酸反应 O2― 2H+ ====H2O
B.将碳酸氢钠溶于盐酸 HCO3- H = H2O CO2 ↑
C.将硫酸氢钠溶液与NaOH溶液混合 HSO4- OH- = H2O SO42-
D.将石灰石溶于硝酸 CO32- 2H = H2O CO2 ↑
9.溶液中存在有五种离子,其中各离子个数比Cl-∶SO42-∶Fe3 ∶K ∶M=2∶3∶1∶3∶1,则M为( )
A.CO32- B.Mg2 C.Na D.Ba2
10.已知Co2O3在酸性溶液中易被还原成Co2 ,还原性强弱顺序I-﹥Fe2 ﹥Cl-﹥Co2 依次减弱。下列反应在水溶液中不可能发生的是 ( )
A.3Cl2 6FeI2===2FeCl3 4FeI3 B.Cl2 FeI2===FeCl I2
C.Co2O2 6HCl==2CoCl2 Cl2↑ 3H2O D.2Fe2 2I-===2Fe2 I2
11.离子方程式CO32- 2H = H2O CO2↑中的CO32-代表的物质可以是 ( )
A.CaCO3 B.NaHCO3 C.Na2CO3 D.BaCO3
12.下列各组反应,前后均可用同一离子方程式表示的是 ( )
A.HCl +Na2CO3, HCl+ NaHCO3 B.HCl +Na2CO3,NaHSO4 +K2CO3
C.H2S +NaOH,H2SO4+KOH D.BaCl2 +Na2SO4,Ba(OH)2+NaHSO4
13.在无色酸性溶液中,下列各组离子能够大量共存的是 ( )
A.Al3 、Cu2+、Cl―、NO3― B.Na+、SO42―、Cl―、Mg2+
C.H+、NH4+、SO32―、CO32― D.Na+、K+、Ag+、Cl―
14.下列化学反应能够发生的是 ( )
A.AgNO3 NaCl=AgCl↓ NaNO3 B.KCl NaOH=KOH NaCl
C.Na2CO3 Cu(OH)2=CuCO3↓ 2NaOH D.Na2SO4 2HCl=2NaCl H2SO4
15.下列离子方程式正确的是 ( )
A.醋酸与氢氧化钠溶液反应:H OH— = H2O
B.碳酸钡放入稀盐酸中:CO32- 2H = CO2↑ H2O
C.铁片放入稀盐酸中:2Fe 6H = 2Fe3 3H2↑
D.硝酸银溶液与氯化钠溶液反应:Ag Cl— = AgCl↓
16.FeS与足量的稀硝酸反应,生成Fe(NO3)3、S、NO和H2O。若反应中有0.3mol的电子转移,则参加反应的硝酸中未被还原的硝酸的物质的量为 ( )
A.0.9 mol B.0.45 mol C.0.3 mol. D.0.1 mol
17.配平下列化学反应方程式:
(1) FeSO4 HNO3 H2SO4— Fe2(SO4)3 NO H2O
(2) MnO4- H2S H — Mn2 S H2O
(3)NaNO2大量用于染料工业和有机合成工业中,然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
____NaNO2 ___KI ___ ______ —____NO ____I2 ____K2SO4 _____Na2SO4 ____ _______
①请完成该化学方程式并配平。
②在上述反应中,若要生成25.4克I2,则电子转移了 个。
③ 上述反应中,氧化产物是________。
A.NO B.I2 C.K2SO4 D.Na2SO4
(4)某一反应体系有反应物和生成物共五种物质: O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→ O2 。则H2O是 (填“反应物”或“生成物”),理由是:
。
(1)(2)
(3)①2, 2, 2, H2SO4-2, 1, 1, 1, 2, H2O
②1.204×1023(或0.2NA)
③B
(4)生成物;由H2O2→O2氧原子数不变,由H2CrO4→Cr(OH)3氧原子数减少,由氧原子守恒可知,H2O应为生成物。
18.某校学生课外活动小组的同学设计如下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题:
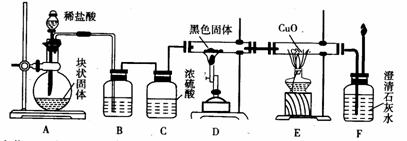
(1)装置B中最适宜的试剂是NaHCO3,其作用是
(2)装置C的作用是 ,若实验中没有装置C,则不可以证明CO具有还原性,
原因是:
(3)装置D中黑色固体为 ,
反应的化学方程式为
(4)根据实验中的 现象,可证明CO具有还原性,
有关反应的化学方程式是
(5)若要根据装置F中出现的现象确认一氧化碳具有还原性,
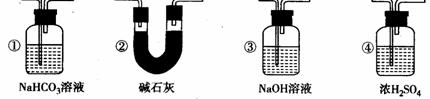
应在上图装置 与 之间连接下图中的 装置(填序号)。
(1)除去CO2混有的HCl
(2)干燥CO2 ;C和H2O反应生成的H2也能还原氧化铜
(3)C;CO2 C=2CO (4)E中黑色固体变红;CO CuO=Cu CO2 (5)DE ;②
19.我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,1982年我国发行面值为10分的丹砂邮票。汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:
反应Ⅰ:HgS O2  Hg SO2 反应Ⅱ:4HgS 4CaO Hg SO2 反应Ⅱ:4HgS 4CaO  4Hg 3CaS CaSO4 4Hg 3CaS CaSO4
请试完成下列各小题:
(1)HgS与氧气反应,氧化剂是
(2)请标出反应Ⅱ中电子转移的方向和数目。(单线桥表示)
(1)HgS和O2

(2)
20.5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式: 。
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,
反应的离子方程式为:HClO2 →ClO2↑+H++Cl-+H2O(未配平)。
当1 mol HClO2发生分解反应时,转移的电子数是 。
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中氧化剂与还原剂的物质的量之比为 。
(1)2ClO3- SO2 = 2ClO2 SO42- (2)B
(3)0.8×6.02×1023 (4)1︰8
|