|
高一(下)化学单元同步练习及期末试题
第五章 原子结构 元素周期律
第一节 原子核
Ⅰ 学习重点
1.掌握原子构成的初步知识.
2.懂得质量数和  X的含义. X的含义.
3.掌握构成原子的粒子间的关系.
4.掌握同位素的概念和元素相对原子质量的计算方法.
Ⅱ 学习难点:
质量数,同位素的相对原子质量、元素的近似相对原子质量和元素的相对原子质量的联系与区别。
Ⅲ 训练练习题:
一、选择题
1.不同元素的原子(包括离子)( )
A.质子数一定不等 B.中子数一定不等
C.质量数一定不等 D.核外电子数一定不等
2.某元素B的核电荷数为Z。已知Bn-Am 的核外具有相同的电子层结构,则A元素的原子序数用Z、n、m来表示,应为( )
A.Z m-m B.Z-n m C.Z-n-m D.Z m n
3.下列微粒中,中子数和质子数相等的是( )
A.①18O;②12C;③26Mg;④40K;⑤40Ca
A.①② B.②⑤ C.只有④ D.③④
4.下列各组微粒具有相同质子数和电子数的是( )
A.OH-和NH4 B.H2O和NH2 C.F-和OH- D.O2-和NH4
5.某元素构成的双原子单质分子有三种,其式量分别为158、160、162。在天然单质中,此三种单质的物质的量之比为1∶1∶1,由此推断以下结论中,正确的是( )
A.此元素有三种同位素 B.其中一种同位素质量数为80
C.其中质量数为79的同位素原子占原子总数的1/2
D.此元素的单质的平均式量为160
6.某元素原子核内质子数为m,中子数为n,则下列论断正确的是( )
A.不能由此确定该元素的原子量
B.这种元素的原子量为m n
C.若碳原子质量为ωg,此原子的质量为(m n)ωg
D.核内中子的总质量小于质子的总质量
7.硼有两种天然同位素105B、115B,硼元素的原子量为10.80,则对硼元 素中105B的质量分数判断正确的是( )
A.20% B.略大于20% C.略小于20% D.80%
8.氢元素有三种同位素,则它们形成的双原子分子有( )
A.3种 B.4种 C.5种 D.6种
9.原子序数为47的银元素有两种同位素,它们的原子百分比近似相等。已知银元素的近似原子量为108,则每种同位素原子里的中子数分别为( )
A.110和106 B.57和63 C.53和73 D.60和62
10.阴离子Xn-含中子N个,X的质量数为A,则mgX元素的气态氢化物中含质子的物质的量是( )
A. 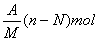 B. B. 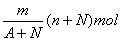
C. 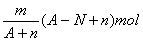 D. D. 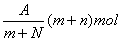
11.同温、同压下,等容积的两个密闭容器中分别充满12C18O和14N2 两种气体,以下关于这两个容器中气体的说法正确的是( )
A.质子数相等,质量不等 B.分子数和质量分别不相等
C.分子数、质量分别相等 D.原子数、中子数和质子数分别相等
12.若某氖原子的质量是ag,12C原子的质量为bg,用NA表示阿伏加德罗常数。下列说法中正确的是( )
A.氖原素的原子量一定是12a/b
B.wg该氖原子的物质的量一定是w/(aNA)mol
C.该氖原子的摩尔质量是aNAg
D.wg该氖原子所含质子数是10w/a
二、填空题
13.某元素M所形成的气态单质为双原子分子,共有三种形式,其式量分别为70、72、74,它们的物质的量之比为9∶6∶1,则:
(1)M有 种同位素,其质量数分别为 ,各 种同位素所占的原子百分比分别为 ;
(2)M2的平均式量为 。
14.质量相同的H2O和D2O所含质子数之比为 ,中子数之比为 ,分别与足量的金属钠反应生成气体在同温同压下体积之比为 。
15.2311Na分别与3517Cl、3717Cl(氯的原子量为35.5)构成的10g氯化钠中,含3717Cl的质量是 。
16.有A、B、C三种二价金属,它们的原子量之比为3∶5∶7,如果把7molA、5molB、3molC混 合,取出均匀混合物5.36g,加入2mol/L HCl150mL恰好完全反应。试求A、B、C三种金属的 原子量,若A、B原子中质子数和中子数相等,C中质子数比中子数少4个,则A、B、C各是什 么元素?
参考答案
第五章 原子结构、元素周期律
第一节 原子核
一、1.A 2.D 3.B 4.BC 5.CD 6.A 7.C 8.D 9.D 10.C 11.A 12.BD
二、13.(1)2、35、37、 75%、25%
(2)71
14.10∶9 8∶9 10∶9
15.1.58g 16.24、40、56 Mg、Ca、Fe
|