|
高一下期第一次双月考化学试题
(时间:100分钟 总分:100分)
可能用到的相对原子质量:
H=1 C=12 N=14 O=16 F=19 S=32 Na=23 Mg=24 Ba=137
化学第一卷(选择题 共50分)
一、单选题(本题共20道小题,每小题只有一个正确选项,每小题2分,共40分。)
1. 某元素的原子最外层有两个电子, 该元素
A. 是ⅡA族元素 B. 是金属元素
C. 是稀有气体元素 D. 无法确定属哪一类
2. 以下物质不能用于脱色或漂白的是
A.SO2 B.Na2O2 C.活性碳 D.H2S
3. 导致下列环境问题的主要原因与排放二氧化硫有关的是
A.酸雨 B.光化学烟雾 C.臭氧空洞 D.温室效应
4. 浓硫酸与金属铝在加热条件下反应,得不到氢气,这是因为浓硫酸具有:
A.强酸性 B.强氧化性 C.脱水性 D.吸水性
5. X是一种黑色粉末,它和浓硫酸共热发生反应,生成无色气体,能使澄清石灰水变得浑浊,当X在氧气中燃烧时也生成无色气体,则X是:
A.硫粉 B.MnO2 C.木炭粉 D.铁粉
6.下列各组指定原子序数的元素, 能够形成A2B3型化合物的是
A. 12和17 B. 11和9 C. 13和8 D. 16和8
7. 共价键可存在于
A.单质 B.离子化合物 C.共价化合物 D.以上各类物质中
8.原子( 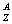 E)的核外电子中,K层和L层电子数之和等于M层电子数的2倍, 则Z的数值是 E)的核外电子中,K层和L层电子数之和等于M层电子数的2倍, 则Z的数值是
A.12 B.15 C.16 D.17
9. 下列各组离子中, 全组离子均与氖原子电子层结构相同是
A.Na 、Mg2 、Al3 、K 、Ca2 B.Li 、Na 、F-、O2 -、Cl-
C.Na 、Mg2 、Al3 、O2-、F- D.S2-、Cl-、K 、Ca2 、Na
10.下列物质的电子式, 正确的是 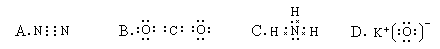
11.元素X的原子获得3个电子和元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确的化学式为
A.Y3X2 B.X2Y2 C.X3Y2 D.Y2X3
12. 下列物质中,含有极性共价键的离子化合物是
A.MgCl2 B.NaOH C.H2S D.SiH4
13. 比较S2-和S的性质,下列叙述正确的是:
A.S2-只具有还原性而S只具有氧化性
B.S2-和S都是不溶于水的淡黄色固体
C.S2-半径比S大,但氧化性S大于S2-
D.它们在空气中都一定能燃烧且都能生成具有刺激性气味的气体
 14. 14. 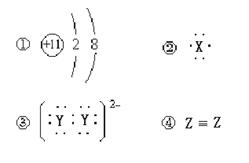
A. ③②①④ B. ③④①② C. ②④③① D. ②④①③
15. 同温同压下,体积相同的两个容器中,分别充满由14N、13C、18O三种原子构成的一氧化氮(14N18O)和一氧化碳(13C18O).下列说法正确的是
A.所含分子数和质量均不相同 B.含有相同的质子和中子
C.含有相同的分子数和电子数 D.含有相同数目的中子、原子和分子
16.水和重水(  H H 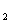 O)分别跟金属钾反应, 若电子转移的数目相同时, 下列化学量相等的是 ①消耗水和重水质量 ②同温同压下生成气体的体积 O)分别跟金属钾反应, 若电子转移的数目相同时, 下列化学量相等的是 ①消耗水和重水质量 ②同温同压下生成气体的体积
③生成气体的质量 ④参加反应的钾的物质的量
A. ①③ B. ②④ C. ①④ D. ②③
17. X和Y均为短周期元素,两者组成的化合物为X3Y2, 若Y的原子序数为m,则X的原子序数不可能是:
A. m+6 B. m+5 C. m-3 D. m-11
18.二氧化硫和氯气都有漂白作用,现把二者以等物质的量混合,让混合物通过湿的有色布条时,其漂白效果
A.和氯气单独通过时相同 B.和二氧化硫单独通过时相同
C.是二者作用效果之和 D.可能失去漂白作用
19. 下列哪组物质都可以充当杀菌消毒剂
A.Cl2、S、P B.CO2、SO2、HClO C.Cl2、SO2、H2O2 D.Cl2、SO2、K2CO3
20. A和B是短周期的两种元素, 它们的离子A-和B2 具有相同的核外电子层结构,下列说法正确的是
A.原子序数A>B B.电子数A>B C. 原子半径A>B D. 离子半径A->B2
二、多选题(本题共5道小题,每小题有1-2个正确答案,每小题2分,共10分。)
21. 各组元素原子半径逐渐变小,氧化性逐渐增强的是
A.K、Na、Li B.P、S、O C.Si、P、O D.O、S、Cl
22. 钋是原子序数最大的氧族元素,推测钋及钋的化合物最不可能具有的性质是:
A.钋是能导电的固体 B.钋与氢气不能直接化合
C.钋的氢化物很稳定 D.钋的熔点较高
23. 关于浓硫酸的叙述错误的是
A.常温下可使金属Fe钝化,故可用铁制器皿盛装浓硫酸
B.在加热条件下可将木炭氧化,其还原产物为CO2和SO2
C.是难挥发的粘稠液体 D.不具有酸性
24. 已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为
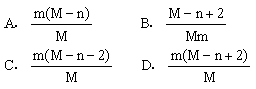
25. 据报道,1994年兰州近代物理研究所研制出首批氧-18气体.氧-18(18O  )又称重氧,下列有关叙述正确的是(NA表示阿伏加德罗常数) )又称重氧,下列有关叙述正确的是(NA表示阿伏加德罗常数)
A. 11.2 L重氧所含分子数为0.5NA B. 36g重氧气体所含原子数为2NA
C. 2g重氧水(H218O)所含中子数为NA D. 1.8g重氧气体的物质的量为0.1mol
化学第二卷(非选择题、共50分)
三、填空题(本题共4道小题,共20分。)
26.(4分) 在O、S、Se、Te四种元素中,单质氧化性最强的化学式是___,简单阴离子还原性最强的离子符号为____. 硒元素最高价氧化物的水化物的化学式为______,它与足量的氢氧化钠溶液反应的化学方程式为_______.
27.(6分) 用化学符号表示符合下列条件的微粒:
(1)含有10个电子的分子有: Ne、 HF 、____、 和 CH4 。
(2)含有10个电子的阳离子有: Na 、____、____、 NH4+和 H3O 。
(3)含有10个电子的常见阴离子有:___、____、和 OH-。
28.(8分)A、B、C三元素原子的核外电子数都比氩原子少, A和C处于同主族, 两者间隔一周期, A元素和B元素的原子两者核电荷数之差为5, B原子核外第3电子层比第2电子层少两个电子, 则B的原子结构示意图为______;A离子的结构示意图为_____;B与C形成化合物的化学式是_____,它的电子式是 它属于 化合物(填“离子”或“共价”);A与B形成化合物的化学式是 , 它的电子式是 ,它属于 化合物。
29.(2分)R2-的M电子层与L电子层的电子数目相等, 元素R应处于周期表的___周期____族.
四、简答题(本题共2道小题,共12分。)
 30.(8分)下图是六种物质的相互转化关系.已知E是固态单质,六种物质中均含有构成E的元素. 30.(8分)下图是六种物质的相互转化关系.已知E是固态单质,六种物质中均含有构成E的元素.
(1) 写出各物质的化学式:
A: B: C:
D: E: F:
(2) 写出①④的化学方程式:
①
④
31.(4分) 按指定元素的价态变化,各写一个化学方程式(每个化学方程式只能用一次)

五、实验题(本题共1道小题,共7分。)
32.(7分)酸性高锰酸钾溶液是一种常用强氧化剂,在化学实验中可用于吸收二氧化硫气体。
浓H2SO4与炭反应,生成的气体产物用下图装置来确认。
请用仪器间相互联接处的标号,写出联接顺序:
__1___接___7_;_____接____;_____接____;___5__接__2____.
并回答:
(1)E试管中盛放的试剂是 ,作用是 .
(2)D装置的作用是 .
(3)写出A装置中反应的化学方程式 ,
B装置中反应的离子方程式 .
六、计算题(本题共2道小题,共11分。)
33.(7分)某工厂的燃料煤中硫的质量分数为0.16%,该工厂每天燃烧这种煤100t。试计算:
⑴如果煤中的硫全部转化为二氧化硫,每天可以产生二氧化硫的质量是多少吨?
⑵这些二氧化硫在标准状况是多少立方米?
34.(4分)
选作题(共20分)
说明:这一部份习题一般同学可以不做。
1.(10分)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出.
进行此实验,所用的仪器及导管如图.
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是 .
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是 .
(3)仪器①的橡皮塞上应有 个孔,原因是 .
(4)实验时,仪器①中除观察到红光外还有 现象.
(5)实验需用约10%H2O2溶液100毫升,现用市售30%(密度近似为1克/厘米3)H2O2来配制,其具体配制方法是 .
(6)实验时仪器①中ClO-与H2O2反应的离子方程式是 .
2.(10分)A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
高一下期第一次双月考化学试题
第二卷(非选择题 共50分)答题卷
班 学号 姓名 |
题号 |
三 |
四 |
五 |
六 |
附加分 |
总 分 | |
得分 |
|
|
|
|
|
| |