|
高一化学(下)期末调研测试
化 学 试 卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分,考试时间75分钟。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 S-32
Cl-35.5 Fe—56 Sn—118.7
第Ⅰ卷(选择题 共69分)
一、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(本大题23小题,每小题3分,共69分)
1. 绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热、天然气等;二级能源中电能、氢能等。下列能源属于绿色能源的是( )
① 太阳能 ② 风能 ③ 石油 ④ 煤 ⑤ 潮汐能 ⑥ 木材
A.①②③ B.③④⑤ C.④⑤⑥ D.①②⑤
2. 下列有关甲烷的说法中不正确的是 ( )
A.采煤矿井中的甲烷气体是植物残体经微生物发酵而来的
B.天然气的主要成分是甲烷
C.甲烷是没有颜色、没有气味的气体,极易溶于水
D.甲烷与氯气发生取代反应所生成的产物四氯甲烷是一种效率较高的灭火剂
3. 下列物质中加入金属钠,不能产生氢气的是 ( )
A.苯 B.蒸馏水 C.无水酒精 D.乙酸
4. 化学反应中的能量变化,通常表现为热量的变化,如Ba(OH)2·8H2O 与NH4Cl的反应要吸收热量,在化学上叫做吸热反应。其原因是( )
A.反应物所具有的总能量高于生成物所具有的总能量
B.反应物所具有的总能量低于生成物所具有的总能量
C.在化学反应中需要加热的反应就是吸热反应
D.在化学反应中需要降温的反应就是放热反应
5. 白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是( )
①检验自来水中是否含氯离子 ②鉴别食盐和小苏打
③蛋壳能否溶于酸 ④白酒中是否含甲醇
A.①② B.①④ C.②③ D.③④
6. 乙烷中混有少量的乙烯,欲除去乙烯可选用的试剂是 ( )
A.NaOH溶液 B.蒸馏水 C.溴水 D.Na2CO3溶液
7. 原电池产生电流的本质原因是( )
A.原电池中溶液能电离出自由移动的离子
B.有两根导线将两个活泼性不同的电极连接
C.电极上进行的氧化还原反应的生成物为电子
D.电极上进行的氧化还原反应中会有电子的转移
8.长征二号F型火箭用的燃料是液态的偏二甲基肼(C2H8N2),氧化剂是液态的N2O4,已知1.5 g火箭燃料偏二甲基肼完全燃烧生成N2、CO2 和液态H2O放出热量50 kJ。下列说法不正确的是( )
A.燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能
B.偏二甲基肼在N2O4 中的燃烧反应是放热反应
 C.该反应中偏二甲基肼和N2O4 总能量低于CO2 、N2和H2O 的总能量 C.该反应中偏二甲基肼和N2O4 总能量低于CO2 、N2和H2O 的总能量
D. 燃烧时的总反应为:C2H8N2 2N2O4 2CO2 3N2 4H2O
9. 下列关于醋酸性质的叙述中不正确的是( )
A.醋酸是一种有强烈刺激性气味的无色液体
B.冰醋酸是无水乙酸,不是乙酸的水溶液
C.醋酸跟碳酸钠溶液发生反应产生CO2
D.在发生酯化反应时,醋酸分子中羟基上的氢原子跟醇分子中的羟基结合成水
10. 除去乙酸乙酯中含有的乙酸,最好的处理和操作是( )
A.蒸馏 B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液 D.用过量氢氧化钠溶液洗涤后分液
11. 随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
12. 下列物质之间的化学反应能用离子方程式“H++OH-=H2O”表示的是( )
A.氢氧化铜和盐酸 B.氢氧化钡和硫酸
C.氨水和硝酸 D.硫酸氢钠和氢氧化钾
13. 下列说法正确的是( )
A.由H形成1 mol H-H键要吸收热量
B.所有燃烧反应都是放热反应
C.16g O3单质中含有的分子个数为NA
D.凡经加热而发生的化学反应都是吸热反应
14. 欲制取较纯净的1,2-二氯乙烷,可采取的方法是 ( )
A.乙烯与Cl2加成
B.乙烯与HCl加成
C.乙烷与Cl2按1∶2的体积比在光照条件下反应
D.乙烯先与HCl加成,再与等物质的量的Cl2在光照下反应
15. 某有机物6.4 g完全燃烧生成8.8 g CO2和0.4mol H2O,无其他物质生成,则下列说法中正确的是( )
A.该有机物仅含碳、氢两种元素
B.该有机物中不一定含有氧元素
C.该有机物中碳氢原子个数比为1∶4
D.该有机物中碳、氢、氧质量比为3∶1∶12
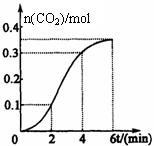 16. CaCO3 与稀盐酸反应(放热反应)生成CO2 的物质的量与反应时间的关系如下图所示.下列结论不正确的是( ) 16. CaCO3 与稀盐酸反应(放热反应)生成CO2 的物质的量与反应时间的关系如下图所示.下列结论不正确的是( )
A.反应开始2 min内平均反应速率最大
B.反应4 min后平均反应速率最小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在第2 min到第4min间生成CO2 的平均反应速率为v(CO2 )=0.1 mol/(L·min)
17. 有人认为人体实际上是一架缓慢氧化着的“高级机器”,人体在生命过程中也需要不断的补充“燃料”。按照这种观点,人们通常摄入的下列物质不能看作“燃料”的是( )
A.水 B.淀粉类物质
C.脂肪类物质 D.蛋白质
18. 下列物质一定不是天然高分子的是( )
A.橡胶 B.羊毛 C.聚乙烯 D.纤维素
19. 苹果汁是人们喜爱的饮料,由于其中含有亚铁离子,在榨取后不久往往会变为棕黄色,生产上常在其中加入维生素C以防止其变色,这是利用了维生素C的( )
A.氧化性 B.还原性 C.酸性 D.碱性
20. 人体内所必需的下列元素中,因摄入量不足而导致骨质疏松的是( )
A.K B.Ca C.Na D.Fe
21.将某病人的尿液加入新制的Cu(OH)2浊液中,微热时如果观察到红色沉淀,说明该尿液中含有( )
A.醋酸 B.酒精 C.食盐 D.葡萄糖
22. 葡萄糖是一种单糖的主要原因是( )
A.糖类中含碳原子数最少 B.不能再水解成更简单的糖
C.分子中只有一个醛基 D.糖类中结构最简单
23. 下列关于蛋白质的叙述中不正确的是( )
A. 我国科学家在1965年首次人工合成具有生命活力的蛋白质—结晶牛胰岛素
B.在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解
C.重金属盐类能使蛋白质凝结,所以误食重金属盐类能使人中毒
D.浓硝酸溅在皮肤上能使皮肤呈现黄色,是由于浓硝酸和蛋白质发生了颜色反应
二、本大题包括4小题,共25 分。
24.(4分)下表是某食品包装袋上的说明,从表中的配料中分别选出相应的物质填在横线上:
|
品名 |
××× |
|
配料 |
鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、
柠檬汁等 |
|
保质期 |
240天 |
|
生产日期 |
标于包装袋封口处 |
(1)富含蛋白质的是____________________________;
(2)富含糖类的是_______________;
(3)富含油脂的是____________________;
(4)富含纤维素的是______________________。
25.(6分)实验一:向银氨溶液中加入1 mL 10%葡萄糖溶液,振荡,然后放在水浴中中加热3~5 min,可观察到试管内壁有银镜生成。
实验二:向盛有0.5 g 淀粉的试管中加入4 mL 20% 的H2SO4 溶液,加热1~2 min ,用碱液中和后,把一部分溶液倒入另一试管(留用),在一试管中加入几滴碘溶液,溶液显蓝色。
根据上述实验,回答下列问题:
(1)用化学方程式表示实验一的结论________________________________________。
(2)甲、乙两同学从实验二得出两种结论:甲同学认为,淀粉没有水解;乙同学认为,淀粉没有完全水解。对此,你认为比较合理的结论是___________(填“甲”或“乙”),理由是________________________________________________。
(3)怎样判断实验二中的淀粉是否水解了?在实验二的基础上,还需要进行的实验是____________________________________________________________________(填实验操作、可能观察到的现象及得出的结论)。
26.(7分)“来自石油和煤的两种基本化工原料”A和甲。A是气态烃,甲是液态烃。B和D 是生活中两种常见的有机物。以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
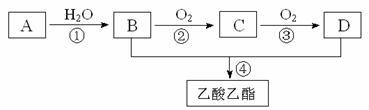
(1)A分子中含有的电子式是 ;C的分子式是_______________。
(2)在反应①~④中,属于加成反应的是________________(填序号)。
(3)B和D反应进行比较缓慢,提高该反应速率的方法主要有______________________
__________________________;写出反应④的化学反应方程式:
___________________________________________________。
(4)可用于鉴别B、D和甲的一种试剂是_____________________。
27.(8分)海水约占地球上总水量的97% 。海水中溶解了大量无机物和有机物,元素共计80多种,是一个远未开发的巨大化学资源宝库。
(1)目前,海水淡化的方法主要有_____________、电渗析法、离子交换法等。从海水中制得的氯化钠除用作食用外,还可用作化工原料,如生产____________________。
(2)工业上从海水中提取溴,第一步是将氯气通入富含溴离子的海水中,将溴置换出来;第二步用空气把溴吹出,用SO2 的水溶液吸收,使溴转化为氢溴酸;第三步用氯气氧化氢溴酸即得单质溴。写出上述第一、二两步发生反应的离子方程式:
①__________________________________;②_____________________________。
(3)目前世界上60%的金属镁是从海水中提取的。海水经过系列处理后,得到氯化镁溶液。无水氯化镁在熔融状态下,通电后会产生镁和氯气,该反应的化学方程式为:
______________________________。
三、本大题包括1小题,共6 分。
28.(6分)通过下列方法可以测定金属锡的纯度:
①将试样溶于盐酸中,发生的反应为:Sn 2HCl =SnCl2 H2 ↑
②加入过量的FeCl3溶液,发生的反应为:SnCl2 2FeCl3 =SnCl4 2FeCl2
③用已知浓度的K2Cr2O7溶液滴定生成的Fe2 ,发生的反应为:
6FeCl2 K2Cr2O7 14HCl =6FeCl3 2KCl 2CrCl3 7H2O
(1)上述氧化还原反应中,HCl 作氧化剂的是____________(填“①”、“②”或“③”)。
(2)现有金属锡样品0.613 g,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液16.0 mL。求试样中锡的质量分数(假设杂质不参加反应)。
化学试卷参考答案及评分建议
一、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(本大题23小题,每小题3分,共69分)
1.D 2.C 3.A 4.B 5.C 6.C 7.D 8.C 9.D 10.C 11.B 12.D 13.B 14.A 15.C 16.A 17.A 18.C 19.B 20.B 21.D 22.B 23.B
三、本大题包括4小题,共25分。
24.(4分)鲜鸡蛋、奶粉 精面粉、白砂糖 精炼植物油、奶油 柠檬汁
(每空1分)
25.(6分)(1)2 Ag(NH3)2OH CH2(CHOH)4CHO → 2Ag↓ CH2OH(CHOH)4COONH4 3NH3 H2O (2分)
(2)乙 淀粉在酸的催化作用下能发生水解,溶液显蓝色说明溶液中还存在淀粉(2分)
(3)在另一试管中加入新制的银氨溶液,稍加热,如产生银镜,说明淀粉已水解(2分)
26.(7分)(1) 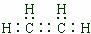 (1分) C2H4O (1分) (2)① (1分) (1分) C2H4O (1分) (2)① (1分)
(3)加入浓硫酸作催化剂、加热、或增加乙酸、乙醇的浓度(1分)
CH3COOH CH3CH2OH  CH3COOCH2CH3 H2O (2分) CH3COOCH2CH3 H2O (2分)
(4)Na2CO3 溶液 (1分)
27.(8分)(1)蒸馏法 烧碱、纯碱、金属钠和氯气(各1分)
(2)2Br- Cl2 =2Cl- Br2 Br2 SO2 2H2O =2Br- SO42- 4H
(3) MgCl2 (熔融) Mg Cl2 (方程式各2分,本题共8分)
三、本大题包括1小题,共6分。
28.(6分)(1)① (2分)
(2)设 试样中锡的质量为x
Sn~2SnCl2~ 2FeCl2 ~ eq \f(1,3) K2Cr2O7
118.7 g eq \f(1,3) mol
x 0.100 mol/L×16.0 mL× eq \f(1,1000) L/mL
118.7 g∶x== eq \f(1,3) ∶0.100 mol/L×16.0 mL× eq \f(1,1000) L/mL
x=0.570 g (3分)
试样中锡的质量分数为: eq \f(0.570,0.613) ×100%=93.0% (1分)
(本题共6分,其它合理答案参照给分)
|