|
化 学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页。满分100分,考试时间为90分钟。
第Ⅰ卷(选择题 共 74 分)
注意事项:
1.答第Ⅰ卷前,考生必将自己的姓名、考号、考试科目、试卷类型(A)涂写在答题卡上。考试结束时,将试题和答题卡一并交回。
2.每小题选出答案后,用铅笔把答题卡上以应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号,不能答在试题卷上。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24 Al 27 Cu—64
一、选择题(本题包括 5 小题,每小题 2 分,共10分。每小题只有一个选项符合题意)
1.最近某市的大街上出现了环保型出租专用车,该车型采用了PLG 汽油的双燃料系统,其尾气中有害物质较普通车型下降了80%左右,缓解了汽车给城市造成的污染,下列物质中不属于上述有害物质的是 ( )
A.CO2和H2 B.NO2和NO
C.CO和SO2 D.炭粒和含铅化合物
2.油炸虾条、薯片等挤压易碎的食品不宜采用真空包装,一般在包装袋中充入某种气体防止食品被直接挤压,你认为下列气体中不宜充入包装袋的是 ( )
A.氮气 B.空气 C.氯气 D.氩气
3.按下列实验方法操作,能达到要求的是 ( )
A.用托盘天平称量25.20g氯化钠固体
B.将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液
C.用紫色石蕊试液鉴别SO2和CO2两种气体
D.用二硫化碳洗涤沾有硫黄的试管
4.下列金属中,一条件下既能跟C12反应,又能跟稀盐酸反应,且均生成MCl2型化合物的是 ( )
A.Al B.Fe C.Cu D.Mg
5.在一定条件下,既能跟CO2反应,又能跟SiO2反应的物质是 ( )
A.碳 B.氢氟酸 C.碳酸氢钠 D.水
二、选择题(本题包括12 小题,每小题3分,共36分。每小题只有一个选项符合题意)
6.下列离子方程式正确的是 ( )
A.金属钠与水反应: 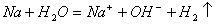
B.碳酸氢钙溶液与稀盐酸反应: 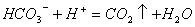
C.Cl2与水反应:Cl2 H2O=HC1 HC1O
D.氢氧化钡溶液与稀硫酸反应: 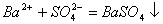
7.食盐、食醋、纯碱均为家庭厨房中常用的物质,利用这些物质不能完成的实验是( )
A.鉴别食盐和纯碱 B.检验蛋壳能否溶于酸
C.除去热水瓶内壁上的水垢 D.检验自来水中是否含C1—
8.设NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.通常状况下,NA个NO分子的质量是30g
B.通常状况下,NA个CO2分子的何种是22.4L
C.100mL 0.1 mol·L-1的H2SO4溶液中H 的个数是0.2NA
D.若1 g N2 含有m个分子,则 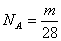
9.资料①:中国科学家以二氧化碳为碳源,跟钠在470℃、80Mpa下反应制备出金刚石。资料②:中国科技大学钱逸泰教授以CC14和钠为原料,在700℃制造出纳米级金刚石粉。下列说法不正确的是 ( )
A.两种制备金刚石的反应过程中,钠均作还原剂
B.金刚石属于金属单质,与石墨、C60等都是碳元素的同素异形体
C.若将“纳米级金刚石粉”溶于适当的溶剂得到的分散系具有胶体的性质
D.资料①中涉及的化学方程式是3CO2 4Na=2Na2CO3 C(金刚石),则制取0.6g金刚石时,反应中共转移0.2mol电子
10.关于铵盐的叙述:①铵盐易溶于水;②铵盐中的氮元素均为-3价; ③铵盐受热易分解;④铵盐只能跟碱3反应,有能跟酸反应;⑤铵态氮肥不宜跟碱性物质如草木灰混合使用。其中正确的是 ( )
A.①②③④⑤ B.①③⑤ C.③④⑤ D. ①②④
11.将钠和碳分别置于右图所示的两个盛满氧气的集
气瓶中燃烧完毕后,打开装置中的两个活塞,这
时观察到 ( )
A.水进入左瓶
B.水进入右瓶
C.水同时进入两瓶
D.水不进入任何一瓶
12.3mol Cu和含7mol H2SO4的浓硫酸共热,充分反应后,未被还原的H2SO4的物质的量为
( )
A.3 mol B.4 mol C.小于4 mol D.大于4 mol
13.浓硫酸和2mol·L-1的稀硫酸,在实验室中敞口
放置。它们的质量和放置天数的关系如右图。
分析a、b曲线变化的原因是 ( )
A.a挥发,b吸水
B.a升华,b冷凝
C.a蒸发,b潮解
D.a冷凝,b吸水
14.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 N2 3C 2AlN 3CO下列叙述中正确的是 ( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.氮化铝中氮元素的化合价为-3
C.因为具有抗冲击、导热性好等优良性能,所以氮化铝属于金属材料
D.合成氮化铝的反应符合“绿色化学”的思想
15.下列实验操作或对实验事实的叙述正确的是 ( )
A.常温下浓H2SO4可贮存于铁制或铝制容器中
B.用氨气做喷泉实验主要是利用氨气的水溶液呈碱性这一性质
C.用瓷坩埚高温熔融NaOH
D.鉴定  :向溶液中加入盐酸酸化的氯化钡溶液 :向溶液中加入盐酸酸化的氯化钡溶液
16.溴的氧化性介于氯和碘之间。利用这一性质判断下列说法正确的是 ( )
A.Cl-、I-离子加入到含Br-的溶液中均可以将 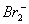 氧化为Br2 氧化为Br2
B.把Cl2缓慢通入含有相同物质的量浓度的Br-、I-的混合溶液里,Br-先被氧化
C.湿润的淀粉碘化钾试纸遇到氯气会变成蓝色
D.KBr溶液中加入碘水发生如下反应:2Br- I2=2I- Br2
17.在通常条件下,NO2和SO2可以很容易发生反应生成NO和
SO3现将碳跟浓硫酸共热产生的气体X和碳跟浓硝酸共热产
生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图
装置),下列有关说法正确的是 ( )
A.洗气瓶中产生的沉淀是碳酸钡
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡
D.反应一段时间后洗气瓶中溶液的酸性减弱
第Ⅱ卷(非选择题 共 54 分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔将答案直接答在试题卷上。
2.答卷前先将密封线内的项目填写清楚。
三、(本题包括2小题,共20分)
18.(6分)某研究性学习小组根据反应Na2SO3(固) H2SO4(浓) Na2SO4 SO2↑ H2O,进行SO2的制备及性质探究实验。请回答下列问题:
(1)将SO2气体分别通入下列溶液中:
①品红溶液,现象是 。
②氢硫酸(H2S水溶液),反应的化学方程式 。
(2)有一小组在实验中发现,SO2气体产生缓慢(不考虑SO2在溶液中的溶解),实验中不存在漏气、反应温度等装置和操作上的问题,请你推测可能的原因(可以不填满):
① 。
② 。
③ 。
19.(14分)含镁3%~5%的铝镁含金是轮船制造、化工生产、机械制造等行业的重要材料。现有一块质量为mg的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案。
方案1:
铝镁合金 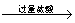 测定生成气体在标准状况下的体积(V1L) 测定生成气体在标准状况下的体积(V1L)
方案2:
铝镁合金 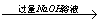 充分反应后测定剩余固体的质量(w1g) 充分反应后测定剩余固体的质量(w1g)
方案3:
铝镁合金 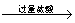 溶液 溶液 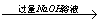 过滤,测定沉淀淀的质量(w2g) 过滤,测定沉淀淀的质量(w2g)
(Ⅰ)某化学实验小组利用右图所示实验装置,按照
方案1进行了实验。请回答下列问题:
①装置中仪器a的名称是 。
②实验装置中有一处明显错误,请指出
。
(Ⅱ)方案2中发生反应的离子方程式为 。
(Ⅲ)方案3“过滤”操作中用到玻璃棒的作用是 ;
若按方案3进行实验,测得的镁的质量分数为 。
(Ⅳ)某同学又设计了与上述方案原理不同的方案4,也测得了镁的质量分数。请你在括号内填上合适的内容,将该方案补充完整。
 方案4:铝镁合金( ) 测定生成气体在标准状况下的体积(V2L)。 方案4:铝镁合金( ) 测定生成气体在标准状况下的体积(V2L)。
四、(本题包括 2 小题,共 20 分)
20.(8 分)
(1)铝热反应在工业生产上有重要应用,如焊接钢轨、焊接大截面钢材部件等。请写出铝与三氧化二铁反应的化学方程式 。
(2)检验溶液中Fe3 存在的试剂是 ,证明Fe3 存在的现象是
。电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。写出该瓜的离子方程式 。
21.(12 分)下图表示某些物质之间的转化关系,每个字母代表一种物质,部分产物已略去。A是一种酸式盐,也是一种常用的化学肥料,B是能使湿润的红色石蕊试纸变蓝色的无色气体,D是无色无味气体。
回答下列问题:
(1)物质A的名称是 。
(2)写出物质B的一种主要用途 。
(3)写出实验室制取气体B的化学方程式 。
写出工业上制取气体B的化学方程式 。
(4)写出反应的化学方程式:
B→E 。
F→G 。
五、(本题包括1小题,共14分)
22.在盛有一定量浓硝酸的试管中加入6.40g铜片发生反应。请回答:
(1)开始阶段,观察到实验现象为
反应的化学方程式是 。
(2)反应结束后,铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式是 。
(3)若6.40g铜片消耗完时,共产生气体2.80L(标准状况)。求整个反应过程中所消耗
的硝酸的物质的量。
参考答案
说明:
1.本答案供阅卷评分使用,考生若写出其他正确答案,可参照评分标准给分。
2.化学专用名词中出现错别字、元素符号有错误,书写不规范,都不得分。
3.化学方程式、离子方程式未配平都不得分。漏掉反应条件扣1分。漏掉↑↓不扣分。
第Ⅰ卷 (选择题,共46分)
一、选择题(每小题2分,共10分)
1.A 2.C 3.D 4.D 5.A
二、选择题(每小题3分,共36分)
6.B 7.D 8.A 9.B 10.B 11.A 12.D 13.A
14.B 15.A 16.C 17. C
第Ⅱ卷 (非选择题,共54分)
三、(20分)
18.(6分)(1)①溶液褪色(2分) ②2H2S SO2 3S↓ 2H2O(2分)
(2)①药品变质(或Na2SO3氧化变质(1分);②硫酸浓度太小(或硫酸浓度太大)(1分)
19.(14分)(Ⅰ)①分液漏斗(2分);②广口瓶中进所导管插入水中,排水导管未插至广口瓶底部(2分)
(Ⅱ)2Al 2OH- 6H2O=2[Al(OH)4]- 3H2↑(2分)
(Ⅲ)引流(2分); 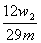 (2分) (2分)
(Ⅳ)过量NaOH溶液(2分)(若未指明用量扣1分;“过量”写为“适量”也正确)
四、(20分)
20.(8分)(1)2Al Fe2O3 2Fe Al2O3(2分)
(2)KSCN(或NH4SCN)(2分),溶液变成血红色(2分)[或NaOH溶液(2分),产生红褐色沉淀(2分)](2分)2Fe3 Cu=2Fe2 Cu2 (2分)
22.(12分)(1)碳酸氢铵(2分)
(2)制氮肥(或制硝酸)(2分)
 (3) (3) 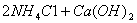 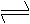  N2 3H2 2NH3(2分))( 写成 N2 3H2 2NH3(2分))( 写成 不扣分)
(4)B→G:4NH3 5O2 4NO 6H2O(2分)
F→G:3NO2 H2O=2HNO3 NO(2分)
五、(14分)
22.(14分)(1)铜片逐渐溶解,溶液逐渐变蓝色(或绿色或蓝绿色),有红棕色气体产生。(加点部分为要点,每个要点2分,共4分)Cu 4HNO3=Cu(NO3)2 2NO2↑ 2H2O(2分)
(2)3Cu 8H 2NO3—=3Cu2 2NO↑ 4H2O(2分)
(3)根据氮原子守恒,可得关系式:
  Cu Cu(NO3)2 2HNO3 Cu Cu(NO3)2 2HNO3
64g 2 mol
6.40g 0.0200 mol(2分)
 NO2 NO2
NO
22.4L 1 mol
2.80L 0.125 mol(2分)
反应中消耗HNO3的物质的量为
0.200 mol 0.125 mol=0.325 mol(2分)
(其他解法只要合理同样得分。未考虑有效数字的扣1分)
|