| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
二、(每题2分,共10分)
| 题号
| 13
| 14
| 15
| 16
| 17
| 答案
|
|
|
|
| |
三、填空题(除标注分值外,每空1分,共22分)
18、按照核电荷数增加的顺序,碱金属元素的名称为 、 、 、 、 ,它们的符号依次是 、 、 、 、 。随着核电荷数的增加,碱金属元素原子的 逐渐增多, 逐渐增大,碱金属元素的 逐渐增强(不考虑其中的放射性元素)。 碱金属前两种元素的原子结构示意图是
、 。
19、钠容易跟空气中的 或 起反应,所以通常保存在 里;氧化钠是 色固体,过氧化钠是 色固体;在呼吸面具里有时用到过氧化钠,请写出有关的主要方程式: (2分)。
四、分析推断题(除标注分值外,每空1分,共10分)
20、 一小块金属钠投入水中,观察到:
= 1 \* GB2 ⑴ 钠浮在水面上,说明: ;
= 2 \* GB2 ⑵ 钠熔成光亮的小球,在水面上四处游动,说明:
;
= 3 \* GB2 ⑶ 反应后的水溶液中加入酚酞试剂呈红色,说明: 。
21、工业上可以CO2、NH3、H2O和NaCl为原料来生产两种固体化工产品。已知:CO2 NH3 H2O = NH4HCO3,且在一定温度下,NH4Cl、NaCl、NH4HCO3和NaHCO3的溶解度存在着这样一种关系: NaCl > NH4Cl > NH4HCO3 > NaHCO3.据此可分析得知,该两种固体化工产品分别为 和 ,其中,前者是通过 加热得到的,后者可作化学肥料。
22、向含a克NaOH的溶液中,缓慢通入b克CO2气体,充分反应后,在低温低压下蒸发溶液,得到不含结晶水的白色固体。白色固体有四种可能组成,请填写下表(在a/b的取值范围和其对应的白色固体组成均正确时,才计分。每组1分,共4分)。
a/b的取值范围
白色固体组成
1
2
3
4
四、计算题(共10分)
23、将20克Na2CO3和NaHCO3的混合物加热到质量不再减少时为止,称得剩余固体的质量为13.8克,求原混合物中NaHCO3的质量分数。(正确使用差量法,计满分7分;正确使用其它方法,计4分)
24、取5.4克由某碱金属R及其氧化物R2O组成的混合物。该混合物与足量的水反应。反应完毕,蒸发反应后得到的溶液,得到8克无水晶体。试通过计算,判断该金属是哪一种碱金属?(同时写出正确的结果和完整的判断过程,计满分3分;否则不计分)
高一化学《碱金属》单元测验试题参考答案
一、选择题(每题只有1个正确选项,每题4分,共48分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
D
D
A
A
B
D
D
B
D
B
A
二、选择题(每题只有一个正确选项,每题2分,共10分)
题号
13
14
15
16
17
答案
CD
D
CD
A
A
三、填空题(除标注分值外,每空1分,共22分)
18、按照核电荷数增加的顺序,碱金属元素的名称为 锂 、 钠 、 钾 、 铷 、 铯 ,它们的符![]()
![]()
![]()
![]()
![]() 号依次是 Li 、 Na 、 K 、 Rb 、 Cs 。随着核电荷数的增加,碱金属元素
号依次是 Li 、 Na 、 K 、 Rb 、 Cs 。随着核电荷数的增加,碱金属元素![]()
![]()
![]() 原子的 电子层数 逐渐增多, 原子半径 逐渐增大,碱金属元素的 金属性 逐渐增强(不考虑其中的放射性元素)。碱金属前两种元素的原子结构示意图是(略)
原子的 电子层数 逐渐增多, 原子半径 逐渐增大,碱金属元素的 金属性 逐渐增强(不考虑其中的放射性元素)。碱金属前两种元素的原子结构示意图是(略)
![]()
![]()
![]() 19、钠容易跟空气中的 氧气 或 水蒸气 起反应,所以通常保存在 煤油 里;氧化钠是
19、钠容易跟空气中的 氧气 或 水蒸气 起反应,所以通常保存在 煤油 里;氧化钠是![]()
![]() 白色固体,过氧化钠是 淡黄色固体;在呼吸面具里有时用到过氧化钠,请写出有关的主要方程式: 2Na2O2 2CO2 = 2Na2CO3 O2 (2分)。
白色固体,过氧化钠是 淡黄色固体;在呼吸面具里有时用到过氧化钠,请写出有关的主要方程式: 2Na2O2 2CO2 = 2Na2CO3 O2 (2分)。
四、分析推断题(除标注分值外,每空1分,共10分)
20、 一小块金属钠投入水中,观察到:
![]() = 1 \* GB2 ⑴ 钠浮在水面上,说明: 钠的密度比水小 ;
= 1 \* GB2 ⑴ 钠浮在水面上,说明: 钠的密度比水小 ;
![]() = 2 \* GB2 ⑵ 钠熔成光亮的小球,在水面上四处游动,说明: 钠与水反应放热,且钠的熔点较
= 2 \* GB2 ⑵ 钠熔成光亮的小球,在水面上四处游动,说明: 钠与水反应放热,且钠的熔点较![]() 低,反应中有气体生成 ;
低,反应中有气体生成 ;
![]() = 3 \* GB2 ⑶ 反应后的水溶液中加入酚酞试剂呈红色,说明: 有可溶性碱生成 。
= 3 \* GB2 ⑶ 反应后的水溶液中加入酚酞试剂呈红色,说明: 有可溶性碱生成 。
21、工业上可以CO2、NH3、H2O和NaCl为原料来生产两种固体化工产品。已知:CO2 NH3 H2O = NH4HCO3,且在一定温度下,NH4Cl、NaCl、NH4HCO3和NaHCO3的溶解度存在着这样一种关系: NaCl > NH4Cl > NH4HCO3 > NaHCO3.据此可分析得知,该![]()
![]() 两种固体化工产品分别为 Na2CO3 和 NH4Cl ,其中,前者是通过 NaHCO3 加热得到的,
两种固体化工产品分别为 Na2CO3 和 NH4Cl ,其中,前者是通过 NaHCO3 加热得到的,![]() 后者可作化学肥料。
后者可作化学肥料。
22、向含a克NaOH的溶液中,缓慢通入b克CO2气体,充分反应后,在低温低压下蒸发溶液,得到不含结晶水的白色固体。白色固体有四种可能组成,请填写下表
a/b的取值范围
白色固体组成
1
(0 , 10/11]
NaHCO3
2
(10/11 , 20/11)
NaHCO3和Na2CO3
3
20/11
Na2CO3
4
(20/11 , ∞)
NaOH和Na2CO3
四、计算题(共10分)
23、将20克Na2CO3和NaHCO3的混合物加热到质量不再减少时为止,称得剩余固体的质量为13.8克,求原混合物中NaHCO3的质量分数。(正确使用差量法,计满分7分;正确使用其它方法,计4分)
解:设原混合物中NaHCO3的质量为k,则由
|
2NaHCO3 === Na2CO3 H2O(g) CO2↑ Δm(s) |
|
Δ |
|
2×84 |
|
62 |
|
k |
|
20 – 13.8 = 6.2 |
|
得 k = 16.8(克) |
|
故 %m(NaHCO3) = (16.8/20) × 100% = 84% |
|
答:原混合物中NaHCO3的质量分数为84% |
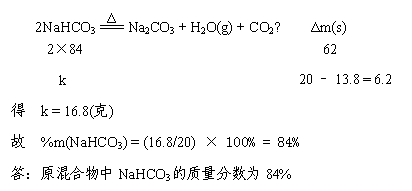 |
24、取5.4克由某碱金属R及其氧化物R2O组成的混合物。该混合物与足量的水反应。反应完毕,蒸发反应后得到的溶液,得到8克无水晶体。试通过计算,判断该金属是哪一种碱金属?(同时写出正确的结果和完整的判断过程,计满分3分;否则不计分)
解:(i) 若5.4克混合物都是碱金属R,则由
|
R ~ ROH |
|
k |
|
k 17 |
|
5.4 |
|
8 |
|
(式中,k为碱金属R的式量) |
|
得 k ≈ 35.3 |
|
R2O ~ 2ROH |
|
2k 16 |
|
2k 34 |
|
5.4 |
|
8 |
|
得 k ≈ 10.7 |
 |
(ii) 若5.4克混合物都是碱金属R的氧化物R2O,则由
综(i)和(ii)所述,碱金属R的式量k的范围为(10.7,35.3)。在碱金属中,只有金属Na的式量23在(10.7,35.3)中,所以该碱金属是金属钠。
| |