| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
A. D的单质可跟B的氢化物的水溶液反应 B. 原子半径B>D>C C. C的最高价氧化物对应水化物可跟D的最高价氧化物对应的水化物反应 D. B的氢化物和A的氢化物都极易溶于水 20.根据中学化学教材所附元素周期表判断,下列叙述不正确的是 A. K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 B. L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 C. L层电子为偶数的所有元素所在族的序数与该元素原子的L层电子数相等 D. M层电子为奇数的所有元素所在族的序数与该元素原子的M层电子数相等 育青中学 专题1检测题答题卷 一、选择题(每小题只有1个正确答案,1-10每题2分,11-20每题3分,共50分)
二、填空题(共50分)
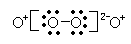
 21、(4分)将下列物质进行分类:① 21、(4分)将下列物质进行分类:① ⑤白磷和红磷 ⑥ ⑨冰和水 ⑩ (1)互为同位素的是 ,(2)互为同素异形体的是 , (3)互为同分异构体的是 ,(4)属于同一种物质的是 。 22. (7分)已知X、Y、Z都是短周期的元素,它们的原子序数依次递增.X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物。则: (1) X是 Y是 Z是 (填名称) (2) 由Y和Z组成,且Y和Z的质量比为7:20的化合物的化学式(分子式)是 (3) 由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种阳离子是 和 。 (4) X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4:2:3,该盐的化学式(分子式)是 。 23. (4分)在下列过程中:①干冰升华;②烧碱熔化;③NaCl溶于水;④Cl2溶于水;⑤O2溶于水;⑥Na2O2溶于水。以上物质化学键未被破坏的是 ;仅离子键被破坏的是 ;仅共价键被破坏的是 ;离子键与共价键都被破坏的是 。 24. (9分)周期表前20号元素中有A、B、C、D、E五种元素,已知它们都不是稀有气体元素,且原子半径依次减小,其中A和E同族,A和C,B与E原子的电子层数都相差2,A、B原子最外层电子数之比为1:4,A和C能形成A2C型离子化合物。试回答下列问题: (1) 写出元素符号:B ,D ,E 。 (2) A和C形成的A2C型离子化合物的电子式: 。 (3) 由A、C、E组成的物质是 键和 键组成的 晶体。 (4) B元素的单质属于 晶体;化合物BC2中 (填有或无)单个的分子 25. (8分) (1) 根据NaH的存在,有人提议可把氢元素放在 族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。 (2) 现有甲、乙两种元素,甲元素在第三周期第VIIA族,甲元素与碘元素相比较,非金属性 较强的是 (填名称),写出可以验证该结论的一个离子方程式 (3) 现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致 密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。 (a)将在空气中放置已久的这两种元素的块状单质分别放入热水中 (b)将这两种元素的单质粉末分别和同浓度的盐酸反应 (c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液 (d)比较这两种元素的气态氢化物的稳定性 26. (12分)下表为元素周期表的一部分。
| 族
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 一
| ①
|
| 二
| ②
|
|
| ③
| ④
| ⑤
| ⑥
| 三
| ⑦
| ⑧
|
|
|
| ⑨
| ⑩
| 四
| = 11 \* GB2 ⑾
|
| = 12 \* GB2 ⑿
|
|
|
| = 13 \* GB2 ⒀ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(1) 表中元素______的非金属性最强;元素______的金属性最强;元素______的单质室
温下呈液态(填写元素符号);
(2) 表中元素 = 12 \* GB2 ⑿的原子结构示意图是____________;
(3) 表中元素⑥⑩ = 13 \* GB2 ⒀氢化物的稳定性顺序为______>______>______(填写化学式,下同);
(4) 表中元素⑨和⑩最高价氧化物对应水化物的酸性:__________>__________。
(5) 写出表中元素③最高价氧化物的结构式 ,表中元素④单质的电子式 。
(6) 写出表中元素⑧和⑩形成化合物的电子式 。
27. (6分)在下列图示中黑点表示原子最外层未共用电子,圆圈表示相同或不同原子及它们的内层电子,圆圈间连线表示共价键,图中7种粒子由原子序数在1-11的元素的原子所构成,请在括号内写出它们的化学式.
|
O |
|
O |
|
O |
|
·· |
|
· |
|
· |
|
O |
|
O |
|
O |
|
|
|
O |
|
·· |
|
|
|
|
|
|
|
|
|
O |
|
O |
|
O |
|
O |
|
O |
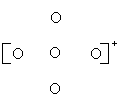 | |||||
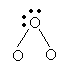 | |||||
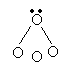 | |||||
( ) ( ) ( )
|
O |
|
O |
|
· |
|
· |
|
·· |
|
·· |
|
- |
|
- |
|
O |
|
O |
|
· |
|
· |
|
· |
|
· |
|
·· |
|
·· |
|
·· |
|
·· |
|
O |
|
O |
|
2- |
|
- |
|
O |
|
O |
|
· |
|
· |
|
·· |
|
·· |
|
- |
( ) ( ) ( )
育青中学 专题1检测题答题卷
一、选择题(每小题只有1个正确答案,1-10每题2分,11-20每题3分,共50分)
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
B |
C |
D |
D |
B |
C |
A |
D |
A |
B |
|
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
答案 |
C |
B |
D |
D |
C |
B |
D |
A |
B |
C |
二、填空题(共50分)
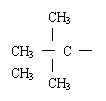
|
CH33 |
|
CH3CHCH2CH3 |

|
CH33 |
|
CH33 |
|
CH3—C—CH3 |
 21、(4分)将下列物质进行分类:①
21、(4分)将下列物质进行分类:① ⑤白磷和红磷 ⑥ ![]() 与
与 ![]() ⑦金刚石和石墨 ⑧ 与
⑦金刚石和石墨 ⑧ 与
⑨冰和水 ⑩ ![]() 与HC
与HC ![]() CH
CH
(1)互为同位素的是 ①⑥ ,(2)互为同素异形体的是 ③⑤⑦ ,
(3)互为同分异构体的是 ④⑧ ,(4)属于同一种物质的是 ②⑨ 。
22. (7分)已知X、Y、Z都是短周期的元素,它们的原子序数依次递增.X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物。则: (1) X是 氢 Y是 氮 Z是 氧 (填名称)
(2) 由Y和Z组成,且Y和Z的质量比为7:20的化合物的化学式(分子式)是 N2O5
(3) 由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种阳离子是 NH4 和 H3O 。
(4) X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4:2:3,该盐的化学式(分子式)是 NH4NO3 。
23. (4分)在下列过程中:①干冰升华;②烧碱熔化;③NaCl溶于水;④Cl2溶于水;⑤O2溶于水;⑥Na2O2溶于水。以上物质化学键未被破坏的是 ①⑤ ;仅离子键被破坏的是 ②③ ;仅共价键被破坏的是 ④ ;离子键与共价键都被破坏的是 ⑥ 。
24. (9分)周期表前20号元素中有A、B、C、D、E五种元素,已知它们都不是稀有气体元素,且原子半径依次减小,其中A和E同族,A和C,B与E原子的电子层数都相差2,A、B原子最外层电子数之比为1:4,A和C能形成A2C型离子化合物。试回答下列问题:
|
K |
|
O |
|
2- |
|
K |
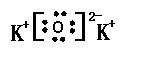 (1) 写出元素符号:B Si ,D F ,E H 。
(1) 写出元素符号:B Si ,D F ,E H 。
(2) A和C形成的A2C型离子化合物的电子式: 。
(3) 由A、C、E组成的物质是 共价 键和 离子 键组成的 离子 晶体。
(4) B元素的单质属于 原子 晶体;化合物BC2中 无 (填有或无)单个的分子
25. (8分) (1) 根据NaH的存在,有人提议可把氢元素放在 ⅧA 族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 ⅣA 族。
(2) 现有甲、乙两种元素,甲元素在第三周期第VIIA族,甲元素与碘元素相比较,非金属性 较强的是 氯 (填名称),写出可以验证该结论的一个离子方程式 Cl2 2I-=2Cl- I2
(3) 现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致 密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。甲、乙两元素相比较,金属性较强的是 镁 (填名称),可以验证该结论的实验是 bc 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
26. (12分)下表为元素周期表的一部分。
族![]() 周期
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
一
①
二
②
③
④
⑤
⑥
三
⑦
⑧
⑨
⑩
四
= 11 \* GB2 ⑾
= 12 \* GB2 ⑿
= 13 \* GB2 ⒀
(1) 表中元素__F____的非金属性最强;元素__K____的金属性最强;元素___Br___的单质室
|
2 |
|
8 |
|
18 |
|
3 |
|
31 |
 温下呈液态(填写元素符号);
温下呈液态(填写元素符号);
(2) 表中元素 = 12 \* GB2 ⑿的原子结构示意图是 ;
(3) 表中元素⑥⑩ = 13 \* GB2 ⒀氢化物的稳定性顺序为__HF_>_HCl__>__HBr___(填写化学式,下同);
(4) 表中元素⑨和⑩最高价氧化物对应水化物的酸性:___HClO4__>__H2SO4___。
(5) 写出表中元素③最高价氧化物的结构式 O=C=O ,表中元素④单质的电子式
|
N |
|
N |
。
|
Mg2 |
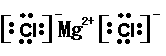 |
(6) 写出表中元素⑧和⑩形成化合物的电子式 。
27. (6分)在下列图示中黑点表示原子最外层未共用电子,圆圈表示相同或不同原子及它们的内层电子,圆圈间连线表示共价键,图中7种粒子由原子序数在1-11的元素的原子所构成,请在括号内写出它们的化学式.
|
O |
|
O |
|
O |
|
·· |
|
· |
|
· |
|
O |
|
O |
|
O |
|
|
|
O |
|
·· |
|
|
|
|
|
|
|
|
|
O |
|
O |
|
O |
|
O |
|
O |
 | |||||
 | |||||
 | |||||
( NH4 ) ( H2O ) ( NH3 )
|
O |
|
O |
|
· |
|
· |
|
·· |
|
·· |
|
- |
|
- |
|
O |
|
O |
|
· |
|
· |
|
· |
|
· |
|
·· |
|
·· |
|
·· |
|
·· |
|
O |
|
O |
|
2- |
|
- |
|
O |
|
O |
|
· |
|
· |
|
·· |
|
·· |
|
- |
( Na2O2) ( OH- ) ( HF )
| |