|
昆明一中高一上学期期末考试化学试题
可能用到的相对原子质量:H 1 Na 23 O 16 Cl 35.5 N 14 C 12 Mg 24 K 39
一、选择题(每小题只有一个选项正确)
1.2004年4月16日,重庆天原化工总厂发生氯气泄漏及爆炸特大事故,喷出的氯气造成了多人伤亡。作为消防干警在现场的下列处理方法和过程较合理的是:
①及时转移疏散人群,同时向有关部门如实报告事故有关情况;
②被转移人群应戴上用浓NaOH处理过的口罩;
③用高压水枪向空中喷洒含碱性物质的水溶液;
④被转移人群可戴上用Na2CO3处理过的口罩(湿润);
⑤将人群转移到地势较低的地方即可,不必走太远;
⑥及时清理现场,检查水源和食物等是否被污染;
⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
A.②③④⑤ B.①③④⑥ C.①②⑤⑥ D.①③⑤⑦
2.21世纪人类正由“化石能源时代”逐步向“多能源时代”过渡,下列不属于新能源的是:
A.电力 B、核能 C、太阳能 D、氢能
3.下列反应中属于吸热反应的是:
A.酸碱中和反应 B.铝和稀盐酸的反应
C.Ba(OH)28H2O与NH4Cl的反应 D.Na2O2与水反应
4..我国政府为了消灭碘缺乏病,广泛使用了碘盐,碘盐就是
A、只有NaI B、只有KIO3 C、NaCl中加适量I2 D、NaCl中加适量KIO3
5.下列叙述正确的是:
A.化合反应一定是氧化还原反应,肯定有元素被氧化,同时有元素被还原
B.有单质参加或生成的反应一定属于氧化还原反应。
C.比较难失电子的原子,获得电子的能力一定强
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原。
6.在反应3Cl2+6KOH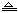 KClO3+5KCl+3H2O中,氧化剂与还原剂质量比为 KClO3+5KCl+3H2O中,氧化剂与还原剂质量比为
A.5:1 B、1:5 C、1:3 D、3:1
7.有如下氧化还原反应:
①2BrO3— + Cl2 = Br2 + 2ClO3— ②5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl
③ClO3— + 5Cl— + 6H+ = 3Cl2 + 3H2O 则氧化性由强到弱的顺序是:
A.ClO3—> BrO3—> IO3—> Cl2 B.BrO3— > Cl2 > ClO3— > IO3—
C.BrO3—> ClO3—> Cl2> IO3— D.Cl2> BrO3—> ClO3— > IO3—
8.下列离子方程式中正确的是:
A.金属钠投入硫酸铜溶液中 2Na + Cu2+ === 2Na+ + Cu
B.碳酸钙与稀盐酸反应 CO32— + 2H+ === H2O + CO2↑
C.醋酸溶液与氢氧化钾溶液反应 H+ + OH—=H2O
D.少量稀盐酸滴加到纯碱稀溶液中,且边滴边振荡 CO32— + H+ == HCO3—
9.我国西部地区蕴藏着丰富的锂资源,开发锂的用途是一个重要科学课题,关于锂的叙述不正确的是:
A.锂是一种最轻的金属 B.锂的熔点低于钠熔点
C.LiOH的碱性比NaOH弱 D.锂可用于制造电池
10.下列关于卤族的叙述,正确的是:
A.单质的颜色随核电荷数的增加逐渐加深
B.氢化物的稳定性随核电荷数的增加逐渐增强
C.单质与水反应均可表示为X2 + H2O == HX + HXO
D.随核电荷数的增加X—的半径递增,还原性递减。
11.保存下列物质的方法正确的是:
A.液溴盛放在带橡胶塞的玻璃瓶中 B.氢氟酸应保存在塑料瓶中
C.苛性钠保存在带玻璃塞的试剂瓶中 D.固体碘放在棕色细口瓶中
12.向CaCl2、MgBr2、KI的混合溶液中通入Cl2后,若溶液中含有Br2,则一定不会含有:
A.I— B。 Cl2 C。Br— D。 Cl—
13.把溴水分别与下列物质混合并充分振荡静置后,溶液分层且上层近乎无色的是:
A.四氯化碳 B.汽油 C.酒精 D.苯
14.设NA代表阿佛加德罗常数,下列说法正确的是
A、2.4克金属镁变成镁离子时失去的电子数目为0.1NA
B、2克氢气所含原子数目为NA
C、在25℃,压强为1.01×105帕时,11.2升氮气所含的原子数目为NA
D、17克氨气所含电子数目为10NA
15.下列物质中所含原子数目最多的是:
A.0.1mol N2 B.4℃时5.4 ml H2O C.标准状况下2.24 L CH4 D.3.4 g NH3
16.同温同压下,某容器充满O2重86 g,若充满CO2重92 g,现充满气体X重84 g,则X的相对分子质量为:
A.42 B。30 C。28 D。50
17.在一个密闭容器中盛有11 g X气体(M=44g/mol)时,压强为1×104Pa。如果在相同温度下,把更多的气体X充入容器,使容器内压强增至5×104Pa,这时容器内气体X的分子数约为:
A.3.3×1025 B。3.3×1024 C。7.5×1023 D。7.5×1022
18.t℃时,NaCl的溶解度为a g,取该温度下的饱和溶液V ml,测得其密度为ρ g/cm3,则下列表达式正确的是:
A.ω(NaCl)=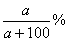 B.n(NaCl)= B.n(NaCl)=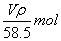
C.c(NaCl)=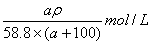 D.n(NaCl)= D.n(NaCl)=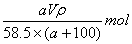
19.下列溶液中的C(Cl—)与50ml 1 molL—1氯化铝溶液中的C(Cl—)相等的是:
A.150 ml 1 molL—1氯化钠溶液 B.75 ml 2 molL—1氯化铵溶液
C.150 ml 1 molL—1氯化钾溶液 D.75 ml 1 molL—1氯化铝溶液
20.只要知道下列哪一组物理量,就可以估算出气体中分子间平均距离:
A.阿伏加德罗常数,该气体的摩尔质量和质量
B.阿伏加德罗常数,该气体的摩尔质量和密度
C.阿伏加德罗常数,该气体的质量和体积
D.该气体的密度、体积和摩尔质量
21.向300 ml KOH溶液中缓慢通入2.24L(标准状况下)CO2气体,充分反应后,在减压、低温下蒸发溶液,得到11.9 g白色固体。则下列说法中正确的是:
A.此白色固体为KOH和K2CO3的混合物 B.此白色固体中含有K2CO3 5g
C.原KOH溶液的物质的量浓度是0.5mol/L D.此白色固体为KHCO3
22. 5.6LCO2气体迅速通过Na2O2固体后得到4.48L气体(气体体积均为标准状况),这4.48L气体的质量为:
A.8.8g B.8.2g C.6.4g D.11g
23.一定量的二氧化锰跟V ml 10 molL—1的盐酸共热制氯气,产生氯气2.24L(标况),则V的取值为:
A.V=20 B。20 < V < 40 C。V=40 D。V > 40
二、填空题
24.(1)4℃时,36ml水的物质的量为______________,含有的水分子数为________________,含有的氧元素质量为______________。
(2)已知在标准状况下,N2和O2的混合气体中,其体积比为4:1,则该气体的密度为_________,质量比为___________;若N2和O2的混合气体中,其质量比为4:1,则该气体的体积比________。
(3)同温同压下,气体A和H2的密度之比为23,则气体A的摩尔质量为______。
(4)在标准状况下,O2和CH4混合气体的密度为1gL—1,则该混合气体中O2和CH4的体积比_________________。
25.(1)写出钠与水反应的离子方程式____________________________________________。
(2)写出漂白粉溶液中通入过量CO2的离子方程式_____________________________。
三、实验题
26.(1)某学生小组进行研究性学习,总共需要0.6mol/LNaOH溶液480ml。现在该学生小组要在实验室配制该溶液。他们开列的实验用品为:托盘天平、砝码、药匙、烧杯、玻璃棒、蒸馏水和烧碱,还缺少的必要仪器是____________和___________。
(2)配制溶液时,需称取烧碱质量_________克
(3)如果该生在配制0.6mol/L NaOH溶液时出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”、“偏低”、“不变”)
① 所用NaOH已潮解,则结果_________。
②所用容量瓶中,已有少量蒸馏水,则结果____________。
③观察刻度线时俯视,则结果________________________。
④定容后,瓶塞盖好,反复上下颠倒,摇匀,发现液面在刻度线之下。则结果_______。
27.下图所示为制取氯气的实验装置;烧瓶中盛放的固体是MnO2。
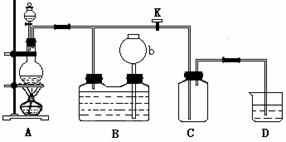
请回答下列问题:
(1) 分液漏斗中盛放的液体是________________________,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为____________________________________________________.
(2) D中盛放的液体是______________________,其作用为___________________。
(3) B中盛放的液体一般是___________。在选取试剂正确且适量的前提下反应开始,当关闭活塞K后发现长颈漏斗b中液面上升并不明显,可能的原因是_____
_____________,检查此原因的简单方法是_____________________________。
(4) 收集氯气完毕,所进行的操作为___________________________,B装置的作用是__________________________________。
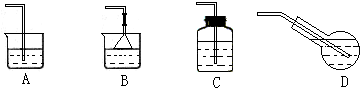
(5) 若制备饱和氯水,应选用的最佳吸收装置是:
四、推断题
28.现有A、B、C、D、E、F、G、H、M九种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,G、E为气体单质,F的水溶液与石灰水混合可制得D的溶液。它们之间相互转化的关系如下图,其他与题无关的生成物均已略去。请回答下列问题:
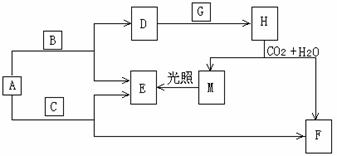
(1) 写出化学式:H____________,C_____________
(2) 写出A + B  D + E反应的化学方程式: D + E反应的化学方程式:
____________________________________________
(3)写出D + G H离子方程式 H离子方程式
______________________________________
五、计算题
29.下图为某市售盐酸试剂瓶标签上的部分数据。问:该盐酸物质的量浓度为多少?(列式计算)

30.(在答题卡)
参考答案
一、填空题(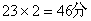 ) )
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
B |
A |
C |
D |
D |
A |
C |
D |
B |
A |
B |
A |
|
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
|
|
A |
D |
B |
C |
C |
D |
D |
B |
C |
B |
D |
|
二、填空题(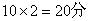 ) )
24.(1)2mol,1.204×1024,32g(2)1.29g/L,7:2,32:7(3)46g/mol (4)2:3
25.(1)2Na+2H2O=2Na++2OH—+H2↑ (2)ClO—+CO2+H2O=HClO+HCO3—
三、实验题(18分)
26.(1)500ml容量瓶,胶头滴管(2)12克 (3)①偏低 ②不变③偏高④不变
27.(1)浓盐酸,MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2)烧碱溶液,吸收多余的氯气(3) 饱和食盐水;装置漏气;用湿润的淀粉碘化钾试纸靠近各连接处检查,漏气处试纸变蓝。(或用肥皂水涂抹在各连接处检查)(2分)(4)先关闭活塞K,再撤去酒精灯;贮存多余的氯气,防止氯气污染环境(5)D MnCl2+Cl2↑+2H2O(2)烧碱溶液,吸收多余的氯气(3) 饱和食盐水;装置漏气;用湿润的淀粉碘化钾试纸靠近各连接处检查,漏气处试纸变蓝。(或用肥皂水涂抹在各连接处检查)(2分)(4)先关闭活塞K,再撤去酒精灯;贮存多余的氯气,防止氯气污染环境(5)D
四、推断题(6分)
28.(1) NaClO,CO2。(2)2Na2O2+2H2O=4NaOH+O2↑(3)Cl2+2OH—=Cl+ClO—+H2O
五、计算题(10分)
29.(4分)11.8mol/L
30.(6分)(1)ω(H2O)=11.8% (2分) (2)n(NaHCO3)=0.01mol n(H2O)=0.03mol n(Na2CO3)=0.03mol x:y:z=3:1:3 (3分) 3Na2CO3 NaHCO33H2O(1分)
|