|
高一化学上学期期中考试A
原子量:H1, C12, O16, Na23, K39, Ca40
一、选择题(只有一个选项符合愿意,2分×20)
1、下列物质属于电解质的是:
(1)H2SO4 (2)蔗糖 (3)Na2CO3 (4)Cu (5)CO2
A. (1)(2)(3) B. (1)(3) C.(2)(4) D. (4)
2、从下列物质中选出强电解质:
A. NH4NO3 B. NH3·H2O C.NaCl溶液 D. CH3COOH
3、下列反应一定属于氧化还原反应的是:
A. 化合反应 B. 分解反应 C.置换反应 D. 复分解反应
4、某物质燃烧或灼烧时,火焰呈黄色,该物质一定含有:
A. 钠原子 D. 钠离子 C. 氯化钠 D.钠元素
5. 少量钠应该保存在:
A.密闭的容器中 B. 水中 C. 煤油中 D. NaOH溶液中
6、下列关于铷的性质的描述不正确的是:
A. 投入水中会发生爆炸性反应
B.铷是一种强还原剂,铷离子很稳定
C. 铷在空气中能燃烧,生成复杂的氧化物
D.铷的金属性比钾和钠弱
7、下列物质中,既能与盐酸反应又能与NaOH溶液反应的是:
A. Na2CO3 B.NaHCO3 C.NaHSO4 D. Na2SO4
8、下列属于氧化还原反应的是:
A. NH4HCO3  NH3↑ H2O CO2↑ B.CuO 2HCl=CuCl2 H2O NH3↑ H2O CO2↑ B.CuO 2HCl=CuCl2 H2O
C.Cl2 2NaOH=NaCl NaClO H2O D. CO2 Na2O=Na2CO3
9、在盛放NaOH溶液的试剂瓶口,时间长了会有白色的固体生成,这固体是:
A. Na2O2 B.Na2CO3 C. Na2SO4 D. NaCl
10、下列微粒只具有氧化性的是:
A.Cu B.Cu2 C.Cl- D.Cl2
11、相同质量的下列物质与足量盐酸反应,产生CO2最多的是:
A. Na2CO3 B. NaHCO3 C. K2CO3 D.CaCO3
12、下列各组物质中的两物质作用时,反应条件或反应物用量改变,对生成物没有影响的是:
A. Na2O2和CO2 B.Na和O2 C.NaOH和CO2 D.C和O2
13、钠在自然界存在的主要形式是:
A.单质 B.氧化物 C,氢氧化物 D.氯化钠
14、金属钠着火后,可用于灭火的物质和器材有:
A.水 B.泡沫灭火器 C.四氯化碳灭火器 D.干砂
15、在强酸溶液中,可以大量共存的离子组是:
A. Na ,K ,CH3CHH-,Cl- B.Al3 ,Mg2 ,SO42-,Cl-
C. K ,Na ,SO42-,CO32- D. Ba2 ,Na ,CO32-,NO3-
16、一定量的氯酸钾加入到浓盐酸中发生如下反应:
KClO3 6HCl(浓)=KCl 3Cl2↑ 3H2O
其中被还原的元素和被氧化的元素间的质量比是:
A.1:6 B. 6:1 C. 2:3 D. 1:5
17、在反应H2S H2SO4=2H2O SO2↑ S↓中,还原产物是:
A. H2O B. S C.SO2 D. H2S
18、有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,笫二份先加热使其完全分解,再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为:
A. 2:1 B.1:1 C. 1:2 D.4:2
19、有关Na2O和Na2O2的下列说法中正确的是:
A.均为碱性氧化物 B.化学性质相同
C. 都能与水反应生成碱 D.都能和CO2反应生成盐和氧气
20、在下列变化中,需要加入氧化剂才能实现的是:
A. Cl→Cl2 B.MnO4-→Mn2 C. CO2→CO D.NaCl→HCl
二、选择题(每小题有1—2个选项符合题意,3分×4)
21、下列离子方程式中,正确的是:
A.稀硫酸滴在铜片上:Cu 2H =Cu2 H2↑
B.硫酸铜溶液与氯化钡溶液混合:SO42- Ba2 =BaSO4↓
C. 盐酸滴在石灰石上:CaCO3 2H =Ca2 CO2↑ H2O
D. 氧化铜与硫酸混合:Cu2 SO42-=CuSO4
22、用下列方法分别制取等质量的氧气:则各反应中电子转移数目之比为
(1)氯酸钾与二氧化锰共热 (2)过氧化钠与水反应
(3)过氧化钠与CO2反应 (4)高锰酸钾受热分解
A.2:1:1:2 B.1:1:1:1 C. 1:2:2:1 D.1:2:1:2
23、在酸性溶液中(加热并有Ag 催化)可发生如下反应:
2Mn2 5R2O8x- 8H2O=16H 10RO4-2 2MnO4-根据上述反应,则R2O8x-中x的值是:
A.4 B. 3 C. 2 D. 1
24、将一小粒金属钠投入以下物质中,能产生气体和沉淀的是:
A. CuCl2溶液 B. MgCl2溶液 C. BaCl2溶液 D.稀硫酸
三、填空题(38分)
25、碱金属元素包括(填符号) 等六种元素。随核电荷数增多,它们的沸点逐渐 。它们的原子最外层都有 个
电子,易 电子,所以它们表现出很强的 性。随着核电荷数增多,它们的原子半径逐渐 ,失电电能力逐渐 ,所以元素金属性逐渐 。
26、Na2O是 色固体,与水反应的化学方程式为,
制备Na2O通常采用的方法是:2NaNO2 6Na=4Na2O N2↑。不采用钠在氧气中燃烧的方法而采用此方法是因为。
27、在K2Cr2O7 14HCl=2KCl 2CrCl3 3Cl2↑ 7H2O反应中,是氧化剂,是还原剂,元素被氧化,元素被还原,HCl现的性质是—。在方程式上标注电子转移数目和方向。
28、除去下列物质中所含少量杂质(括号内为杂质)的方法是(用化学方程式表示):(3)(4)小要求写出离子方程式
(1)Na2O2((Na2O)
(2)Na2CO3固体(NaHCO3固体)
(3)KCl溶液(K2CO3)
(4)NaHCO3溶液(Na2CO3)
29、将NaHCO3固体在试管中加热,将产生的气体依次通过足量的Na2O2固体。浓硫酸,最后得到的气体是 。
30、要鉴别KNO3和NaNO3固体,应利用 方法。
31、有四种某碱金属元素的化合物W、X、Y、Z,已知它们进行焰色反应时火焰呈紫色(透过蓝色钴玻璃观察)。根据以下反应式推测并写出各物质化学式及指定反应的离子方程式:(己知Y中两元素原子个数比1:1)(1)W=X CO2↑ H2O (2)Y CO2=X O2
(3)Y H2,O=Z O2↑ (4)X Ca(OH)2=Z CaCO3↓
写出下列物质化学式:W X Y Z
写出离子方程式:
Y H2O
Z CO2
四、计算题(第一小题6分,第二小题4分)
32、将一块重2.92克的表面被氧化的金属钠(氧化物按氧化钠计),投到97.08克水中,产生0.1克气体,试求:
(1)未被氧化的金属钠的质量
(2)所得溶液中溶质的质量分数
33、含有碳酸钠、碳酸氢钠、过氧化钠的固体混合物35.2克,加热使其充分反应后,产生的气体全部通入12.4克氧化钠中充分反应,固体质量变为14.2克,在此固体中加入盐酸不产生气体。将35.2克混合物加热后的残留固体冷却称量为31.8克的纯净物,求原混合物中各物质的质量。
北方交大附中03-04年上学期高一化学期中考试答案
一、选择题(1—20题,每小题2分)
1.B 2.A 3.C 4.D 5.C 6.D 7.B 8.C 9.B 10.B 11.B 12.A 13.D 14.D 15.B 16.D 17.C 18.B 19.C 20.A 21.BC 22.A 23.C 24.AB
二、(21—24题为二题每小题3分)
三、填空题(化学方程式,离子方程式,电了转移方向和数目,26题原因每空2分余空1分)
25. Li .Na .K .Rb .Cs .Fr ;降低;失去;还原;增大;增强;增强。
26. 白;Na2O H2O=2NaOH;Na在O2中燃烧产物为Na2O2,不是Na2O ;且Na与NaNO2反应后除生成Na2O外,还生成N2,避免Na2O与空气接触。
27. K2Cr2O7;HCl;Cl‑1;Cr b;还原性和酸性
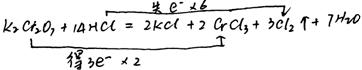
28.
(1) 2Na2O O2  2Na2O2 2Na2O2
(2) 2NaHCO3  Na2CO3= H2O CO2↑ Na2CO3= H2O CO2↑
(3)CO32- 2H H2O CO2↑或CO32- Ca2 =CaCO3↓
(4)CO32- H2O CO2=2HCO3-
29. O2
30. 焰色反应
31. KHCO3; K2CO3; K2O2;KOH
2K2O2 2H2O=4K 4OH- O2↑
2OH- CO2=CO32- H2O 或OH- CO2=HCO3-
四.32
(1)2.3g(2分)
(2)m(Na2O)=0.62g(1分)
m(NaOH)=4.8g(1分)
m(液)=2.92g 97.08g-0.19=99.9g(1分)
2Q=4.9g/99.9g×100%≈4.8%(1分)
 33. 2HaHCO3 33. 2HaHCO3  Na2CO3 H2O CO2↑ Na2CO3 H2O CO2↑
2Na2O2 2H2O=4NaOH O2↑ (1分)
2Na2O2 2CO2=2Na2CO3 O2
m(H2O)=1.8g(1分)
m(Na2O2)=7.8g(1分)
m(Na2CO3)=10.6g(1分)
|