|
高一化学上册八中期中诊断性联考检测
高一化学
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,第I卷l至4页,第Ⅱ卷5至8页。考试时间为90分钟,满分100分。
第I卷(选择题 共50分)
注意事项:
l、答第I卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2、每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案,不能答在试题卷上。
3、考试结束后,监考人将答题卡和第II卷一并收回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有1个正确选项符合题意。)
1.下列变化过程中,只发生物理变化的是
A.葡萄酿酒
B.酸雨侵蚀建筑物
C.空气液化制取氮气
D.在实验室桌面上的玻璃片中用小刀切一小块钠
2.下列物质的分类合理的是
A.氧化物;CO2、NO、SO2、H2O、CuO
B.碱:NaOH、Ba(OH)2、Cu(OH)2、KOH、Na2CO3
C.铵盐:NH4NO3、NH4Cl、(NH4)2CO3、NH3·H2O
D.碱性氧化物:CaO、Na2O2、Na2O、Mn2O7、SO3
3.下列关于氯气的叙述中,不正确的是
A.氯气是一种黄绿色、有刺激性气味的有毒气体
B.氯气能溶于水得氯水,液氯和氯水是不同的物质
C.加热时,钠在氯气中剧烈燃烧,产生黄色火焰,生成氧化钠
D.铁丝在氯气中燃烧生成三氯化铁
4.顺铂[化学名称为顺二氯二氨合铂(Ⅱ),化学式为PtCl2(NH3)2]是一种用于治疗癌症的药物。下列说法中不正确的是
A.顺铂是一种化合物 B.顺铂中铂元素的化合价为 2价
C.顺铂是Pt、Cl2、NH3组成的混合物 D.顺铂中含有4种元素
5.下列电离方程式错误的是
A.HClO=H++ClO- B.NaHCO3=Na++HCO3-
C.NaHSO4=Na++H++SO42- D.Ba(OH)2=Ba2++2OH-
6.下列说法中,不正确的是
A.19世纪中叶,俄国化学家门捷列夫的突出贡献是发现元素周期律
B.英国科学家波义耳提出原子学说,标志着近代化学的诞生
C.化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器
D.1965年,我国化学家首次人工合成了具有生理活性的结晶牛胰岛素
7.要除去氯化铁溶液中的少量氯化亚铁,可行的办法是
A.滴入KSCN溶液 B.通入氯气 C.加入铁粉 D.加入烧碱溶液
8.下列离子方程式的书写中,不正确的是
A.硫酸钾溶液与氯化钡溶液反应:Ba2++SO42-=BaSO4↓
B.金属铜与硝酸银溶液反应:Cu+Ag+=Ag+Cu2+
C.金属钠与水反应:2Na 2H2O=2Na++2OH-+H2↑
D.大理石与醋酸溶液反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
9.分析下列每组中物质的组成规律,每组中都有一种物质与其他物质在分类上不同,括号内为不同于其他物质的物质。下列关于不同于其他物质的确定及叙述正确的是
(1)NaCl、KCl、CaCl2、NaClO(NaClO:是含氧酸盐,Cl的化合价与其他化合物中的不同。)
(2)H3PO4、H2SO4、HNO3、HCl(HCl:是无氧酸,其他为含氧酸。)
(3)浊液、溶液、胶体、水(水:水是纯净物,其他物质是混合物,属于分散系。)
(4)铜、金、钠、汞、铁(汞:是液态金属,其他物质是固态金属。)
A.都正确 B.都不正确
C.只有(1)(3)正确 D.只有(2)(4)正确
10.下列叙述中,能说明某物质一定是强电解质的是
A.在水溶液中完全电离
B.熔化时不导电
C.水溶液的导电能力强
D.溶液中已电离的离子和未电离的分子共存
二、选择题(本题包括10小题,每小题3分,共30分。每小题有1~2个选项符合题意。两个选项的,只选一个且正确的得1分。多选、错选均不得分。)
11.下面的说法中正确的是
A.物质的量就是物质的质量
B.阿伏加德罗常数没有单位
C.物质的量的单位是摩尔,表示为mol;kg·mol-1是摩尔质量的单位
D.物质的量是国际单位制中七个基本物理量之一
12.下列各组离子中,能在溶液中大量共存的是
A.Na+、Ag+、NO3-、Cl- B.Cu2+、K+、SO42-、H+
C.OH-、Mg2+、SO42-、Cl- D.Ba2+、H+、SO42-、NO3-
 13.下列反应中,既属于氧化还原反应,又属于分解反应的是 13.下列反应中,既属于氧化还原反应,又属于分解反应的是
A.CaCO3=====CaO+CO2↑ B.2KMnO4====K2MnO4+MnO2+O2↑
C.Na2CO3+2HCl==2NaCl+H2O+CO2↑ D.2Fe3++Cu==2Fe2++Cu2+
14.下列各反应,能用2H++CO32-==H2O+CO2↑表示的离子反应为
A.碳酸钠溶液和醋酸溶液 B.碳酸钡和盐酸溶液
C.碳酸氢钠溶液和氢氧化钠溶液 D.碳酸钾和稀硫酸’
15.下列各组物质作用时,反应条件或配比改变,对生成物没有影响的是
A.氧氯化钠和盐酸 B.氧化钙与水 C.钠和氧气 D.木炭和氧气
16.下列说法中,不正确的是
A.氢氧化铁胶体中分散质微粒直径为1~100nm
B.可用丁达尔现象判断胶体的制备是否成功
C.溶液一定是均一、稳定的混合物
D.长期放置后不会分层的液体,就是溶液
17.下列叙述正确的是
A.氯化钠溶液在电流作用下电离成钠离子和氯离子的过程叫电离
B.凡溶于水后能电离出氢离子的化合物都是酸
C.二氧化碳溶于水后能导电,故二氧化碳属于电解质
D.硫酸钡难溶于水,但溶解部分完全电离,故硫酸钡是强电解质
18.能表示阿伏加德罗常数数值的是
A.1 mol金属钠含有的电子数 B.标准状况下,22.4 L水中所含的分子数
C.0.012 kg12C所含的原子数 D.1 L1mol·L-1的硫酸溶液中所含的H+数
19.下列叙述中,正确的是
A.还原剂还原性的强弱是由失电子的难易决定,与失电子的数目无关
B.金属阳离子被还原后,一定得到该元素的单质
C.不易失去电子的物质,一定容易得到电子
D.20℃、101 kPa条件下,30g一氧化氮和2g氢气所占体积一定相同
20.下列事实与胶体的性质无关的是
A.向豆浆中加入盐卤做豆腐
B.清晨在密林中看到一缕缕光束
C.将植物油倒入水中用力搅拌形成油水混合物
D.向三氯化铁溶液中滴加氨水生成沉淀
第Ⅱ卷(非选择题 共50分)
注意事项:
1.第II卷共4页,用钢笔或圆珠笔直接答在试卷上。
2.答题前,将密封线内的项目填写清楚。
可能用到的相对原子质量:H l C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5
三、(本题包括2小题,共20分。)
21.(8分)
 氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在—定条件下,AlN可以通过反应Al2O3+N2+3C====2AlN+3CO合成。请回答下列问题: 氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在—定条件下,AlN可以通过反应Al2O3+N2+3C====2AlN+3CO合成。请回答下列问题:
(1)AlN中氮元素的化合价为 ,AlN的摩尔质量为 。
(2)在上述反应中,氧化剂是 ,还原剂是 。
(3)根据元素化合价的变化,C→CO的变化过程是 反应。
 (4)上述反应中,若转移电子的物质的量为6 mol,则反应生成的AlN的物质的量为 。 (4)上述反应中,若转移电子的物质的量为6 mol,则反应生成的AlN的物质的量为 。
22.(12分)
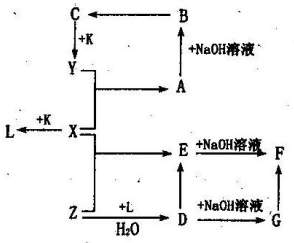
已知X、Y、Z、K为常见的单质,其余为化合物。化合物B在溶液中为蓝色沉淀,化合物F为红褐色,K在X中燃烧生成化合物L,并且产生苍白色火焰。它们有如图所示的转化关系。
(1)写出下列物质的名称:
Y 、Z 、
G 。
(2)写出下列化学反应的方程式:
X+K→L: ,
在空气中发生G→F: 。
(3)发生下列化学反应时,能观察到的现象是:
X+Y→A的反应现象: ,
D+NaOH溶液→G的反应现象: 。
(4)写出下列反应的离子方程式:
Z→D: ,
E→D: 。
(5)一种可能由化合物D和E组成混合溶液,要判定化合物E存在,你所选的试剂是
,应观察到的现象是 。
四、(本小题15分。)
23.(15分)
(1)下面是某同学研究过氧化钠性质过程中的片断。请你帮助他完成部分实验并补全活动记录。
步骤I:过氧化钠的颜色、状态: 色, 态。
步骤Ⅱ:类比氧化钠与水反应生成氢氧化钠的反应,过氧化钠与水反应可能有氢氧化钠生成。
步骤Ⅲ:取一个小烧杯,向其中加入少量的过氧化钠固体,然后加入适量的蒸馏水,充分振荡后再向其中滴加酚酞溶液。现象①:用手触摸烧杯,感觉烫手,得出的结论是 ;现象②: ,原因是有碱生成,得出的结论是:生成的碱是 ;现象③:有大量的气泡产生,验证该气体的方法是 (填写操作、现象、结论)。现象④……
步骤Ⅳ:写出氧化钠和过氧化钠分别与水反应的化学方程式: , 。两反应的共同点是 。写出氧化钠、过氧化钠中氧元素的化合价:氧化钠 。过氧化钠 。
(2)在上述过程中,他用到了研究物质性质的方法有 。
五、(本小题15分。)
24.(15分)
某化学课外活动小组计划用NaOH溶液制取简易消毒液,反应原理为: 写出氯气与NaOH溶液反应的离子方程式)。
(1)实验室有已配好的NaOH溶液,一瓶是所贴标签是4.0 mol·L-1,另一瓶所贴标签为14%(密度为114 g·mL-1正以)。则14%的NaOH溶液的物质的量浓度为 。(列出算式,得出结果)。
(2)若要使1.12 L氯气(STP)与4.0mol·L-1。NaOH溶液恰好完全反应,所需NaOH溶液的体积为 。
(3)配制250mL 4.0 mol·L-1NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
f.盖好瓶塞,反复上下颠倒,摇匀。
①d步骤中所用到的仪器有 (填名称)。
②c步骤中所用的容量瓶壁上,标出的物理量及其数值为 。
③上述步骤的正确操作顺序是 (填序号)。
(4)玻璃棒是化学实验中常用的仪器。下列有关实验过程中,肯定需要使用玻璃棒进行操作的是 (填序号)。
a.一定溶质质量分数溶液的配制。
b.用普通漏斗组成的过滤装置进行过滤实验。
c.将适量的氯化铁饱和溶液滴入沸水制氢氧化铁胶体。
期中诊断性检测
高一化学参考答案
说明:
1.本答案供阅卷评分时使用,考生若写出其他合理答案,请参照标准评分
2.化学专用名词出现错别字、元素符号错误不给分,化学用语书写不规范的酌情扣分。
3.化学方程式或离子方程式不配平的不得分。
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有1个正确选项符合题意。)
1.C 2.A 3.C 4.C 5.A 6.B 7.B 8.B 9.A 10.A
二、选择题(本题包括10小题,每小题3分,共30分。每小题有1~2个选项符合题意。两个选项的,只选一个且正确的得1分。多选、错选均不得分。)
11.CD 12.B 13.B 14.D 15.AB 16.D 17.D 18.C 19.AD 20.CD
21.(8分)
(1)﹣3 (1分)41 g·mol﹣(2分,单位占1分。)
(2)N2(1分)C(1分)
(3)氧化(1分)(4)2 mol(2分,单位占1分)
22.(12分)
 (1)铜(1分) 铁(1分) 氢氧化亚铁(1分) (1)铜(1分) 铁(1分) 氢氧化亚铁(1分)
(2)H2+Cl2====2HCl(1分) 4Fe(OH)2+O2+2H2O=4Fe(OH)2(2分,配平占1分。)
(3)产生棕黄色的烟(1分) 产生白色沉淀(淡绿色消失)(1分)
(4)Fe+2H-=H2↑+Fe2+(1分) Fe+2Fe2+=3Fe2+或其他合理答案(1分)
(5)KSCN溶液(1分) 溶液呈血红色(1分)
23.(15分)
(1)淡黄色(1分) 固(1分) 反应放热(1分) 酚酞变红(1分) 氢氧化钠(NaOH)(1分) 用一带火星的木条,插入小烧杯中,木条复燃,证明气体是氧气(2分) Na2O H2O=2NaOH(1分) 2Na2O2 2H2O=4NaOH O2↑(1分) 都生成NaOH(都放热)(1分) -2(1分) -l(1分)
(2)观察法、实验法、比较法(3分)
24.(15分)
(1)Cl2 2OH-=ClO-+Cl-+H2O(1分) 1000mL×1.14 g·mL-1×14%÷40g·mol-1 =3.99 mol·L-1(3分)
(2)25 mL(2分,单位1分。)
(3)烧杯、玻璃棒(2分) 容积250 mL、温度20℃(2分) abdcef(3分)
(4)ab(2分)
|