|
满分:100分 时间:90分钟
命题:梁文轩
一、选择题(每小题仅有一个正确选项,2′×10=20′)
1、医疗上常用硫酸钡作X射线透视肠胃的内服药剂,俗称“钡餐”,这时利用了硫酸钡什么性质
A、不溶于水 B、不溶于酸 C、不易被X射线透过 D、以上均是
2、C60与现代足球有很相似的结构,它与石墨互为
A、同位素 B、同素异形体 C、同分异构体 D、同种物质
3、飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。漂尘在空气中与SO2接触时,会使SO2转化为SO3,使空气酸度增加,飘尘所起的作用是
A、氧化剂 B、还原剂
C、催化剂 D、吸附剂
4、医疗上使用放射性核素 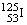 治疗肿瘤,该核素原子核内的中子数与电子数之差是 治疗肿瘤,该核素原子核内的中子数与电子数之差是
A、19 B、53 C、72 D、125
5、既有离子键,又有非极性共价键的化合物是
A、NaOH B、NH4Cl C、Na2O2 D、H3PO4
6、向50 mL18 mol/L硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量(n)是
A、n<0.45mol B、n=0.9mol
C、0.45mol<n<0.9mol D、n=0.45mol
7、元素周期表中第七周期为不完全周期,若未来发现的元素将第七周期全填满,则下列推论可能错误的是
A、第七周期元素都是放射性元素
B、该周期原子序数最大的元素单质一定不与任何物质反应
C、该周期0族元素的原子序数为118
D、该周期ⅢA族元素的氢氧化物性质与Al(OH)3不同
8、鉴别SO2和CO2,可将它们分别通入
①盛有澄清石灰水的洗气瓶 ②盛有品红溶液的洗气瓶
③盛有溴水的洗气瓶 ④盛有氯化钡溶液的洗气瓶
A、①和④ B、①和② C、②和③ D、③和④
9、与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是
A、MgBr2 B、Na2S C、CCl4 D、NaF
10、实验室中,某学生用下列方法清洗所用仪器,其中不正确的是
A、用二硫化碳清洗沾有硫磺的试管
B、用酒精清洗做过碘升华实验的烧瓶
C、用稀盐酸清洗盛过饱和石灰水的试剂瓶
D、用稀硫酸清洗做完氢气还原氧化铜的试管
二、选择题(每小题仅有一个正确选项,3′×10=30′)
11、下列各组性质比较中正确的是
A、酸性:HClO4>H2SO4>H3PO4>H2SiO3
B、碱性:NaOH>KOH>Mg(OH)2>Al(OH)3
C、稳定性:HF<HCl<H2S<PH3
D、还原性:S2->Se2->Br->Cl-
12、下列叙述中正确的是
A、阳离子一定是金属离子,阴离子一定只含非金属元素
B、某金属元素的阳离子与某非金属元素的阴离子组成的物质一定是纯净物
C、离子化合物都是强电解质,都易溶于水
D、阳离子的半径小于其原子的半径,阴离子的半径大于其原子的半径
13、在某溶液中含有HCO3-、SO32-、CO32-、Cl-,若向其中加入适量的Na2O2固体,则溶液中离子浓度基本保持不变的是
A、HCO3- B、SO32- C、CO32- D、Cl-
14、某金属元素的离子X2+ 有6个电子层,最外层上有2个电子。当把XO2溶于浓盐酸时,有黄绿色气体产生。则下列说法中正确的是
①该元素是ⅣA族元素 ②X2+具有强还原性
③XO2具有强氧化性 ④该元素是ⅡA族元素
A、①和③ B、①和② C、②和③ D、②和④
15、已知某元素X的一种同位素的质量数为A,中子数为N,则下列各判断不正确的是
A、这种同位素的符号可表示为 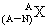
B、A小于X元素的相对原子质量
C、A可代表这种同位素的近似相对原子质量
D、A不能代表X元素的相对原子质量
16、下列变化中,不需要破坏化学键的是
A、食盐熔化 B、干冰气化
C、氯化氢溶于水 D、氯化铵受热分解为氨气和氯化氢
17、二硫化碳(液体)能够在氧气中完全燃烧,生成二氧化碳和二氧化硫。若在标准况状下,用0.1 mol二硫化碳在1mol氧气中完全燃烧,则反应后气体混合物在标准况状时的体积为
A、22.4L B、6.72L C、13.44L D、15.68L
18、24mL浓度为0.05mol/L的Na2SO3溶液,恰好与20mL浓度为0.02mol/L的K2Cr2O7溶液完全反应,则Cr元素在还原产物中的化合价为
A、+4 B、+3 C、+2 D、+1
19、下列各组离子,能在溶液中大量共存的是
A、Ag+、K+、I-、NO3- B、H+、Na+、CO32-、MnO4-
C、Ba2+、Al3+、Cl-、SO42- D、H+、Mg2+、Cl-、 SO42-
20、已知反应:KClO3+6HCl=KCl+3Cl2↑+3H2O,若用K35ClO3与H37Cl作用,下列说法正确的是
A、此反应中,每生成3molCl2转移电子6mol
B、生成物KCl中只含有37Cl
C、生成的Cl2中只含有35Cl
D、生成Cl2的相对分子质量为72
三、填空题(方程式2′×5=10′,其余1′×18=18′,本题共计28′)
21、(5′)A、B两种气体都是大气污染物,严格禁止向大气中排放,在工业上常用碱液来吸收。已知A具有还原性,B是一种单质,其水溶液都具有漂白作用。
⑴A是 ,B是 。
⑵若A、B同时作用于一潮湿的有色布条上,其漂白效果会 (填增强、减弱或不变),原因是(用化学方程式表示) 。
22、(10′)有原子序数均小于20的A、B、C、D四种元素,已知:①A和B在同一主族,C和D在同一周期;②四元素相互间可形成A2C、A2C2、B2C2、DC2等化合物;③B的阳离子与C的阴离子核外电子层结构相同;④B2C2与A2C或DC2反应都生成C2气体;⑤B的单质与A2C反应生成A2气体,A2与C2混合遇火可发生爆炸,生成常温下无色无味的液体A2C。试回答:
⑴写出A和D两元素的名称:A 、D ;画出B离子和C离子的结构示意图:
B 、C ,两种离子中,半径较小的是 (写离子符号)。
⑵写出A2C2、B2C2、DC2的电子式:
A2C2 ;B2C2 ;DC2 。
⑶写出B2C2与DC2反应的化学方程式 。
23、(7′)⑴工业上制取漂白粉的化学方程式为 。
⑵漂白粉的有效成分是 ,向其溶液中通入少量CO2,反应的化学方程式是
。
⑶若向漂白粉有效成分的溶液中通入适量SO2,有学生认为反应的离子方程式为:Ca2 +2ClO-+SO2+H2O=CaSO3↓+2HClO。你认为是否合理,简述原因:
。
24、(6′)甲、乙、丙三位同学各设计了一个实验,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试液中含有SO42-。
甲的实验方案是:试样A(无色溶液)  白色沉淀 白色沉淀  沉淀不溶解; 沉淀不溶解;
⑴乙认为甲的实验不严谨,因为试样A中若含有 离子(仅填一种),也会有此现象。
乙的实验方案是:试样B(无色溶液) 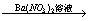 白色沉淀 白色沉淀 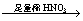 沉淀不溶解; 沉淀不溶解;
⑵丙认为乙的实验不严谨,因为试样B中若含有 离子(仅填一种),也会有此现象。
丙的实验方案是:试样C(无色溶液)  现象Ⅰ 现象Ⅰ  现象Ⅱ; 现象Ⅱ;
⑶若丙方案合理,则回答:其中试剂 = 1 \* ROMAN I是 ,现象 = 1 \* ROMAN I是 ;试剂 = 2 \* ROMAN II是 ,现象 = 2 \* ROMAN II是 。
 (你若认为丙方案不合理,以上四空可以不填) (你若认为丙方案不合理,以上四空可以不填)
四、推断题(2′×4=8′)
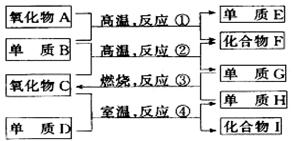
25、(8′)有物质A~I,它们之间的相互转化关系如下图所示。
已知:①单质E可用为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈弱酸性,它能与氧化物A发生非氧化还原反应生成C和另一种化合物。
据此,请回答:
⑴化合物F是 。
⑵化合物I是_ 。
⑶反应②的化学方程式是_____ ___ 。
反应④的化学方程式是________ 。
五、实验题(本题共8′)
26、(8′)下图虚线框中的装置可用来检验浓H2SO4与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
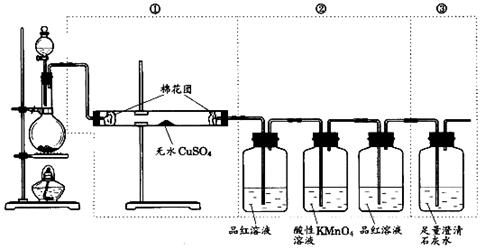
⑴写出浓H2SO4与木炭粉反应的化学方程式:________ 。
⑵如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是 ;不能检出的物质是 。
⑶如果将仪器的连接顺序变为①、③、②,则可以检出的物质是 ;不能检出的物质是 。
⑷如果将仪器的连接顺序变为②、③、①,则可检出的物质是 ;不能检出的物质是 。
六、计算题(本题共6′)
27、(6′)将8.8g FeS固体置于200ml 2.0mol/L的盐酸中,可制备H2S气体,反应完全后H2S气体部分溶于水,若溶液中H2S的浓度为0.1mol/L,假定溶液体积不变,试计算:
⑴部分溶于水后能收集到的H2S气体的体积(标准状况)。(2′)
⑵溶液中Fe2+和H+物质的量浓度。(2′×2=4′)
  高一下学期 五月月考 高一下学期 五月月考
化学答题卷
选择题答题栏: |
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 | |
答案 |
|
|
|
|
|
|
|
|
|
| |
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 | |
答案 |
|
|
|
|
|
|
|
|
|
| | ![]() 、
、 ![]() ,Na+。
,Na+。