|
[原人教版] 物质的量
本试题分为第Ⅰ卷和第Ⅱ卷两部分,第Ⅰ卷为选择题,共45分;第Ⅱ卷为非选择题,共55分。满分100分,考试时间为90分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 Mn 55 S 32
第Ⅰ卷(选择题,共45分)
一、选择题(每题3分,共45分)
1.下列说法正确的是 ( )
A.物质的量可理解为物质的质量
B.物质的量就是物质的粒子数目
C.物质的量是量度物质所含粒子多少的一个物理量
D.物质的量的单位——摩尔只适用于分子.原子和离子
2.与1.8 g H2O含有相同氢原子数的H2SO4为 ( )
A.9.8 g B.4.9 g C.0.1 g D.0.2 g
3.设阿伏加德常数为NA。则下列说法正确的是 ( )
A.温常压下,11.2L甲烷中含有的氢原子数为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2 数为0.2NA
4.对于物质的量相同的硫酸和磷酸,下列说法不正确的是 ( )
A.分子个数相等 B.含有的氧原子数相等
C.含有的氢原子数相等 D.质量相等
5. 4 ℃时,若20滴水恰好为1 mL,那么1滴水中所含的水分子数约为(NA表示阿伏加德罗常数的值) ( )
A.20NA B.NA/360 C.9 NA/10 D.360/NA
6.等质量的下列各气体中,含有的分子个数最多的是 ( )
A.Cl2 B.H2 C.O2 D.CO
7.有Mg、Al、Fe、Cu四种金属,若两两混合,取26 g混合物与足量稀硫酸反应,产生11.2 L H2(标准状况),此混合物的组合的方式最多有 ( )
A.2种 B.3种 C.4种 D.5种
8.15克A和10.5克B完全反应,生成7.2克C,1..8克D和0.3mol E,则E的摩尔质量为 ( )
A.100g/mol B.27.5 g/mol
C.55 g/mol D.16.5 g/mol
9.在一定温度下,已知有关某饱和溶液的一些数据:
①溶液的质量, ②溶剂的质量,
③溶液的体积, ④溶质的摩尔质量,
⑤溶质的溶解度, ⑥溶液的密度.
利用下列各组数据计算该饱和溶液的物质的量浓度,不能算出的一组是 ( )
A.④⑤⑥ B.①②③④ C.①④⑥ D.①③④⑤
10.将标准状况下的a L氨气溶于1000 g水中,得到氨水的密度为b g·cm-3,则该氨水的物质的量浓度为 ( )
A. 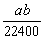 mol·L-1 B. mol·L-1 B. 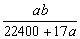 mol·L-1 mol·L-1
C. 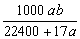 mol·L-1 D. mol·L-1 D.  mol·L-1 mol·L-1
11.取100 mL 0.3 mol·L-1和300 mL 0.25 mol·L-1的硫酸注入500 mL的容量瓶中,加水稀释至刻度线,该混合溶液中H 的物质的量浓度是 ( )
A.0.21 mol·L-1 B.0.56 mol·L-1
C.0.42 mol·L-1 D.0.26 mol·L-1
12.相同体积的Na2SO4、MgSO4、Al2(SO4)3溶液分别加入过量的BaCl2溶液,得到沉淀的物质的量之比为1∶1∶3,这三种溶液的物质的量浓度之比为 ( )
A. 1∶1∶1 B.1∶1∶3 C. 2∶2∶3 D.3∶3∶1
13.标况下,a L气体X2和b L气体Y2完全反应生成c L气体Z,若2a = 6b = 3c时,Z的化学式为 ( )
A.XY2 B.X2Y C.XY3 D.X3Y
14.在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是
( )
A.用量筒量取浓盐酸时俯视读数
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
15.向密度为d g·cm-3的盐酸中逐滴加入硝酸银溶液到过量,生成沉淀的质量与原盐酸的质量相等,原盐酸的物质的量浓度为 ( )
A.25.4d mol·L-1 B.12.7d mol·L-1
C. 6.35d mol·L-1 D. 6..97d mol·L-1
第Ⅱ卷(55分)
二、非选择题(55分)
16.(8分)在标准状况下的四种气体:①11.2L H 2② 0.25 mol H 2 S ③ 36.5g HCl ④ 6.8 g NH3,其中质量由大到小的顺序是(以下均填序号) ;各物质所含原子数由多到少的顺序为 ;其体积由大到小的顺序为 ;气体密度由大到小的顺序为 。
17.(6分)标准状况下11.2L,由CO和H2组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为__________;此混合气体完全燃烧消耗氧气的体积(标准状况)为_________L;将燃烧产物通过足量过氧化钠后,固体增重___________g。
18.(13分)
(1)配制250 mL 1 mol·L-1 H2SO4溶液,溶解所用的仪器是_______,用于引流的是_____________,用于加水使溶液的凹面正好跟刻度线相切的是_________。
(2)配制100 mL1mol / L氢氧化钠溶液,下列操作中错误的是 ( )
A.在托盘天平上放两片大小一样的纸,然后将氢氧化钠放在纸片上进行称量
B.把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解.冷却,再把溶液移入容量瓶中
C.用蒸馏水洗涤烧杯.玻璃棒2~3次,洗涤液也移入容量瓶中
D.沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹面恰好与刻度相切
(3)用18mol/L硫酸配制100mL 1.0mol/L硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平
C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
G.50mL烧杯 H.100mL容量瓶。
实验时应选用仪器的先后顺序是(填入编号)_____________。
(4)在容量瓶的使用方法中,下列操作不正确的是_____________(填写标号)。
A.使用容量瓶前检查它是否漏水。
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗。
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线。
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线。
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指拖住瓶底,把容量瓶倒转和摇动多次。
19.(14分)实验室用98%的浓H2SO4(ρ=18.4 g·cm-3)配制1.5 mol·L-1稀H2SO4溶液100mL。
(1)计算所需浓H2SO4体积为_________。
(2)精确(精确到0.1mL)量取所需浓H2SO4,选用量具的名称是___________。
(3)稀释浓H2SO4的方法(简要操作)是_____________________________________。
(4)容量瓶使用前,检验其是否漏水的方法是_______________________________。
(5)稀释后的浓H2SO4应_________转移至容量瓶中。
(6)向容量瓶中继续加水至刻度1~2 cm处,改用胶头滴管逐滴加水,使溶液的凹面与刻度线恰好相切。在这一步操作前尚缺少的一步操作是_________________,如果缺少这一步操作,将导致结果_________________。
20.(6分)常温下将20.0 g 14.0%的NaCl溶液跟30.0 g 24.0 %的NaCl溶液混合,得到密度为1.15g·mL-1混合溶液;计算:
(1)该混合溶液的溶质质量分数;
(2)该混合溶液物质的量浓度;
(3)1000 g水中需加多少摩NaCl,才能使其浓度恰好与上述混合液的浓度相等?
21.(8分)通常情况下,CO和O2的混合气体m L 用电火花引燃,体积变为n L(前后条件相同)
(1)试确定混合气体中CO和O2的体积
(2)当反应后的气体密度在同样条件下为H2密度的15倍,试确定反应后气体的成分。
参考答案
1.C 2.A 3.C 4.C 5.B 6.B 7.C 8.C 9.C 10.C 11.C
12.A 13.D 14.C 15.D
16.(8分,每空2分)③、② 、④ 、① ; ③、④ 、①、② ; ③、① 、④ 、② ;
③、② 、④、①
17.(6分,每空2分)14.4g/mol;5.6;7.2
18.(12分)(1)烧杯、玻璃棒 ;玻璃棒; 胶头滴管(6分)
(2)A (2分)
(3)EFGCH (2分)
(4)BCD(3分)
19.(14分,每空2分)(1)8.2 mL
(2)量筒。
(3)向盛有100 mL 水的烧杯中慢慢滴加H2SO4,并不断搅拌,冷却。
(4)向容量瓶中加入少量的水倒置,观察是否漏液,然后旋转180°,重复检验。
(5)沿玻璃棒
(6)未洗涤烧杯及玻璃棒2~3次,洗涤液未转移至容量瓶中; 偏低。
20.(6分,各2分)
(1) 
(2)  mol/L mol/L
(3)设1000g水中需溶于x mol NaCl,则 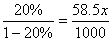 ,x=4.27mol ,x=4.27mol
21.(8分,各4分)
解:(1)2CO O2 = 2CO2
2 1 2 ΔV=1
2(m-n) m-n m – n
= 1 * GB3 ① O2过量:VCO =2(m-n) VO2 = m-2(m-n) = 2n-m
= 2 * GB3 ② CO过量:VO2 = m-n VCO = m - (m-n) = n
(2)  =15 M = 30 故只可能是 CO 过量,则最后气体为一氧化碳和二氧化碳 =15 M = 30 故只可能是 CO 过量,则最后气体为一氧化碳和二氧化碳
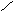 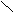 CO 28 14 CO 28 14
30 VCO = 7n/8 VCO2 = n/8
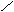 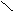 CO2 44 2 CO2 44 2
|