|
苏教版高一化学第一学期期中试卷
命题人:虞加强
说明:l、本卷满分100分,考试时间90分钟;
2、请将试题答案全部填写在答题卷上,否则无效;
3、参考相对原子质量:H一1; C一12 ;O一16; S一32; Na一23; Fe一56 ;Mg一24;
Al一27; N---14; Cl---35.5;Cu—64; Zn—65;Ca—40; K—39; Mn—55;
一.选择题(本题共25小题,每小题2分,共50分。每小题仅有一个选项符合题意):
1·在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为 ( )
A.元素 B·单质 C.分子 D.氧化物
2.下列物质中属于纯净物、化合物、无机化合物、盐、钙盐的是 ( )。
A·石灰石 B.Ca(OH)2 C.CaC03 D.CH4
3、如果1g水中有m个氢原子,则阿伏加德罗常数为( )
A.m/9 B.9m C.2m D.m/2
4.四种因素:①温度和压强、②所含微粒数、③微粒本身大小、④微粒间的距离,其中对
气体物质体积有显著影响的是 ( )
A.②③④ B.②④ C.①②④ D.①③④
5.在一定温度和压强下,1体积X2(气)和3体积Y2 (气)化合生成2体积气态化合物,
则该化合物的化学式为 ( )
A.X3 Y B.X2Y C. XY3 D.X2Y3
6.用特殊方法把固体物质加工到纳米级(1-100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米
材料。下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是( )
A.溶液 B.悬浊液 C.胶体 D.乳浊液
7.下列物质能导电且为电解质的是 ( )
A.酒精 B.Na2S04晶体 C.熔化的KCl D.Cu
8.下列实验操作中错误的是( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,选择有机萃取剂,则溶质在萃取剂的溶解度必须比水大
9.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为
A.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
10.只用下列试剂中的一种,就能鉴别氢氧化钠、氢氧化钙和盐酸三种无色溶液,它是 ( )
A.酚酞试液 B.氯化钡溶液 C.石蕊试液 D.碳酸钠溶液
11.下列有关溶液物质的量浓度的说法正确的是 ( )
A.把1 molNaCl溶于1 L水中所得溶液物质的量浓度为1mol/L
B. 把0·1 molNaCl投入100 mL容量瓶中加水至刻度线,充分振荡后,浓度为1 mol/L
C. 把7.4gCa(OH)2放入烧杯中,加水搅拌冷却后全部转移到100 mL容量瓶并加水至刻度,
浓度为1 mol/L
D.需要78 mL 0.1 mol/L的Na2C03溶液,应选用l00 mL容量瓶
12.将标准状况下的aLHCl(g)溶于1000克水中,得到的盐酸密度为b g/cm3,则该盐酸的物
质的量浓度是( )
A.a/22.4 (mol/L) B.ab/22400(mol/L)
C. ab/(22400 36.5a) (mol/L) D. 1000ab/(22400 36.5a) (mol/L)
13. 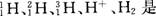
A.氢的五种同位素 B.五种氢元素 C.氢的五种核素 D.氢元素的五种不同微粒
14. Rn 离子有m个电子,它的质量数为A,则原子核内的中子数为
A.m n ; B.A - m n; C.A – m - n ; D.A m – n;
15.下列能验证电解饱和食盐水溶液(含酚酞)产物的装置是( )。
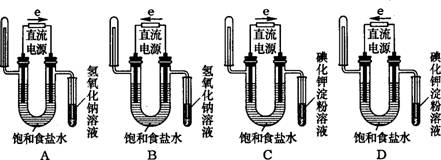
16.当周围空间有大量Cl2存在时,可以用浸有一定浓度某种物质的毛巾捂住鼻子,该物
质最适宜采用的是 ( )
A.NaOH B.KI C.NH3·H20 D.Na2C03
17.方志敏烈士生前在狱中曾用米汤(内含淀粉)给鲁迅先生写信,鲁迅先生收到信后,为
了看清信中的内容,使用的化学试剂是 ( )
A.碘化钾 B.碘酒 C.溴水 D.碘化钾淀粉溶液
18.向含有NaBr和KI的混合溶液中通入过量氯气充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体是 ( )
A.NaCl和KI B.NaCl和I2 C.KCl和NaBr D.KCl和NaCl
19.下列反应中,属于氧化还原反应的是
A.  B. B. 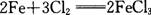
C. 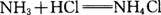 D. D. 
20.下列反应需要加入还原剂才能实现的是
A.S—→S02; B.Cu2 —→Cu; C. Mn2 —→MnO4—; D. Zn—→Zn2
21.已知在适宜的条件下发生如下反应:
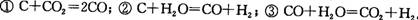 由此可以判断,在该温度下,C、CO、H2的还原性强弱顺序是( )。 由此可以判断,在该温度下,C、CO、H2的还原性强弱顺序是( )。

22.金属钠长期露置于空气中,最后变为 ( )
A.Na20 B.Na2 02 C.NaOH D.Na2C03
23.金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是( )。
A.BaCl2溶液 B.K2S04溶液 C.FeCl3溶液 D.NH4NO3溶液
24.把l.15 g Na投入 9g水中,溶液中水分子和Na 的物质的量之比是 ( )
A.10:l B.100:1 C. 1:9 D. 9:1
25.用NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.0.5mol Na与足量盐酸反应转移电子数为1NA
B.标准状况下,11.2LBr2所含的分子数为0.5NA
C.0.1molCH4所含的电子数为1NA
D.46gNO2和N2O4的混合物含有的分子数为1NA
二、填空题(本题包括5小题,共40分)
26.(6分)写出下列反应的化学方程式,并用双线桥法标出电子转移情况:
将溴水加入碘化钠溶液中:________________________________;其中氧化产物是__________.
27.(10分) (1)自来水一般用氯气消毒,用化学方程式说明用自来水配制下列物质的溶液不合适的原因。
① 配制KBr溶液。化学方程式为____________________________。
② 配制AgN03溶液。化学方程式为________________________________。
(2) KOH溶液中滴入1滴酚酞,溶液呈红色。将新制的饱和氯水逐滴滴入上述红色溶液中,发现红色变浅,最后成无色溶液。
A.解释产生褪色现象的可能原因:
①__________________________________________________________________________.
②________________________________________________________________________。
B.请在红色消失的溶液中进行有关实验,以证明红色消失的真正原因。简要写出有关操作、现象与结论。
28.(8分)实验室用密度为1.18 g/cm3、质量分数为36.5%的浓盐酸配制250 mL 0.1 mol/L的盐酸,请回答下列问题:
(1)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次).________________。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅拌,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度线l~2 cm处
(2)溶液注入容量瓶前需恢复到室温,这是因为________________________________________
________________________________________________________________________________.
(3)若出现如下情况,对所配溶液浓度将有何影响?
定容时仰视:________ (填“偏低”、“偏高”或“无影响”)。
(4)若实验过程中出现如下情况如何处理?
向容量瓶中加蒸馏水时不慎超过了刻度线:______________。
29.(8分)有一瓶澄清的溶液,其中可能含NH4 、K 、Na 、Cu2 、Fe3 、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显紫色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有___________,肯定不存在的离子有__________________。
不能确定是否存在的离子有__________________________。请设计简单实验方案证明它(们)是否存在(写出实验方法、现象、结论)________________________________________
______________________________________________________________________________
30.(8分)有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其
M层(第三层)电子数比L层(第二层)少1个电子;C元素的原子得到2个电子;D元素的
原子失去1个电子,所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
⑴上述四种元素中C的名称是
⑵画出A离子的结构示意图 ,画出B离子的结构示意图 , 画
出D原子的结构示意图 .
三.计算题.(10分)
31、用KMn04 氧化质量分数为36.5%的盐酸(此盐酸溶液的密度为1.19g/cm3)。反应方程式如下:
2KMn04 16HCl=2KCl 2MnCl2 5C12↑ 8H20
(1)31.6g KMn04能使多少克HCl被氧化? 产生的Cl2在标准状况下的体积为多少升?
(2)若将10毫升36.5%的盐酸溶液稀释到 100ml,则稀释后的盐酸溶液的物质的量浓度是多少mol/L?
答题纸
一 .选择题(本题共25小题,每小题2分,共50分。每小题仅有一个选项符合题意) |
题
号 |
答案 | |
19 |
| |
20 |
| |
21 |
| |
22 |
| |
23 |
| |
24 |
| |
25 |
| |
|
| |
|
| |