|
高 一 化 学 试 题
制卷人: 韩为春
请你注意:
1.本卷共有 25小题。 2.考试时间6 0分钟,满分100分。
3.可能用到的相对原子质量:
H 1 C 12 N 14 O 16 S 32 Na 23 Cu 64 Fe 56 Zn 65
一.我会选 (单选题 包括10小题,每题2分,共20分。)
1. 导致下列现象的主要原因,与排放SO2有关的是 ( )
A.酸雨 B.光化学烟雾 C.臭氧空洞 D.温室效应
2. 下列变化不属于化学变化的是 ( )
A.SO2使品红溶液褪色 B.氯水使有色布条褪色
C.活性炭使红墨水褪色 D.H2O2水溶液使染料褪色
3.起固定氮作用的化学反应是
A.N2和H2在一定条件下反应生成NH3 B.NO与O2反应生成NO2
C.NH3催化氧化生成NO D.由NH3制NH4HCO3和(NH4)2SO4
4. 下列反应是氧化还原反应,又可用离子方程式表示的是 ( )
A.锌与硫酸铜溶液反应 B.镁和氧气反应
C.氯化钠溶液和硝酸银溶液 D.铁锈和硫酸
5. 为除去CO2气体中混有的少量杂质S02气体,应选用的试剂是 ( )
A.Na2CO3溶液 B.NaHCO3溶液 C.NaOH溶液 D.NaHSO3溶液
6. 能够用于鉴别CO2和SO2的试剂是 ( )
A.品红溶液 B.紫色石蕊试液 C.澄清石灰水 D. 氯化钡溶液
7. 未做实验而欺骗老师的学生是 ( )
A.老师,我用Na2S03溶液与BaCl2作用,有白色沉淀生成,加入稀盐酸后沉淀消失
B.老师,我向Ba(OH)2溶液中通入SO2气体,也有沉淀生成
C.老师,我向BaCl2溶液中通入SO2气体,也出现了白色沉淀
D.老师,我向用硝酸酸化过的BaCl2溶液中通入SO2气体,也出现了白色沉淀
8. 下列反应中浓硫酸既表现酸性,又表现氧化性的是 ( )
A. 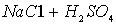  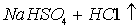
B.CuO H2SO4═CuSO4 H2O
C.Cu 2H2S04(浓)  CuSO4 SO2↑ 2H2O D.C 2H2S04(浓) CuSO4 SO2↑ 2H2O D.C 2H2S04(浓)  CO2 2SO2↑ 2H2O CO2 2SO2↑ 2H2O
9. 工业废气中氮氧化物是主要的大气污染源之一。已知2NO2 2NaOH=NaNO3 NaNO2 H2O, NO2 NO 2NaOH=2NaNO2 H2O。
现有a mol NO2和b mol NO的混合气,若用足量的NaOH溶液将其完全吸收,则混合气中两种气体的物质的量必须满足的关系( )
A.a=b/3 B.2a=b C.a≥b D.a<b
10. 已知下列氧化剂均能氧化 4价的硫元素,为除去稀硫酸中混有的亚硫酸,以得到纯净的稀硫酸,应选用的最合理的氧化剂是 ( )
A.KMnO4 B.Ca(ClO)2 C.H2O2 D.Cl2
二、我会选(本题包括10个小题,每小题3分,共30分,每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题即得0分。)
11. 将2体积的SO2和1体积的Cl2(同温、同压下)充分混合后,通入加有品红溶液的BaCl2溶液中,可观察到的现象是 ( )
A.溶液褪色 B.产生白色沉淀 C.溶液不褪色 D.产生黄色沉淀
12. 检验某未知溶液中是否含有 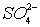 的下列操作中最合理的是 ( ) 的下列操作中最合理的是 ( )
A.加入硝酸酸化了的硝酸钡溶液 B.先加硝酸酸化,再加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液 D.加入盐酸酸化了的氯化钡溶液
13. 用1L lmol/L NaOH溶液吸收0.8mol C02,则所得溶液中  和 和  物质的量浓度之比约为 ( ) 物质的量浓度之比约为 ( )
A.1:3 B.2:1 C.2:3 D.3:2
14. 下列实验操作中,所使用的有关仪器要求干燥的是 ( )
A.配制一定物质的量浓度的溶液时所用的容量瓶
B.用氯化铵和熟石灰混合加热时所用的试管
C.做喷泉实验时用来收集氨气的烧瓶
D.用亚硫酸钠跟硫酸反应制二氧化硫气体时所用的反应容器烧瓶
15. 质量为m g的铜与浓H2S04恰好反应,生成SO2气体,在标准状况下体积为V L,则被还原的硫酸为 ( )
A.m/64 mol B.m/32 mol C.98V/22.4 g D.64V/22.4 g
16.a molCu和含b molHNO3的溶液恰好完全反应,则被还原的HNO3的物质的量一定是( )
A、(b-2a)mol B、b/4 mol C、2a/3 mol D、2a mol
17. 将3.20gCu跟30.0mL 10.0mol/L的HN03充分反应,还原产物有NO和N02。若反应后溶液中有a mol H 离子,则此时溶液中含  离子的物质的量为 ( ) 离子的物质的量为 ( )
A. 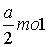 B.2a mol C.0.1a mol D.(a 0.1)mol B.2a mol C.0.1a mol D.(a 0.1)mol
18. 下面是实验室制取氨气的装置和选用的试剂,其中错误的是 ( )
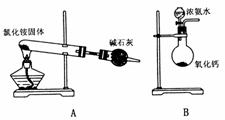 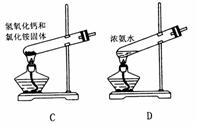
19. 下列各组离子在水溶液中能大量共存的是 ( )
A. I-、H 、 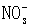 、K B.K 、Fe2 、Cl-、 、K B.K 、Fe2 、Cl-、 
C. 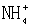 、OH-、Cl-、Na D.CO32-、K 、H 、Cl- 、OH-、Cl-、Na D.CO32-、K 、H 、Cl-
20.你认为减少酸雨产生的途径可采取的措施是
①用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.③⑤ D.①③④⑤
   卷Ⅱ(非选择题,共50分) 卷Ⅱ(非选择题,共50分)
三. 我会填(10分)
21. (10分) 在下列用途或反应中,硫酸表现出的性质为:(A)高沸点性;
(B)强酸性;(C)吸水性;(D)脱水性;(E)强氧化性。请用字母填空:
(1)实验室制取氢气 ( )
(2)干燥二氧化硫 ( )
(3)浓硫酸溶解金属银 ( )
(4将浓硫酸加到浓盐酸中产生白雾 ( )
(5)浓硫酸可使湿润的蓝色石蕊试纸先变红,后变黑 ( )
四.我会设计 (共16分)
22. (1)浓硫酸与木炭粉在加热条件下反应的化学方程式
为 ;
(2)试用下图所列各装置设计一个实验,验证上述反应所产生的各种产物.这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):
→ → → .
(3)实验时观察到装置①中 A瓶的溶液褪色,C瓶的溶液不褪色.
A瓶溶液的作用是 ,
B瓶溶液的作用是 ,
C瓶溶液的作用是 .
(4)装置②中所加的固体药品是 ,验证的产物是 ,
确定装置②在整套装置中位置的理由是 .
(5)装置③中所盛溶液是 .可验证的产物是 .
五.我会推断 (10分)
23.下图中A为黄色的固体,B,C为溶液,D为气体,E,F为白色沉淀。
(1) A为____________,B为__________________,C为________________,
D为___________,E为___________________,F为_________________。
(2)  写出B C的化学方程式:_______________________________ 写出B C的化学方程式:_______________________________
(3)  写出C F的离子方程式:_______________________________ 写出C F的离子方程式:_______________________________
六、我会算 (14分)
24. (5分)含FeS270%的硫铁矿在煅烧时,有2%的硫受到损失而混入炉渣.S02转化为SO3时,其转化率为85%.由这样的硫铁矿2 t可以制得98%的硫酸多少吨?
25.(9分)向铜片中加某浓度的硫酸120mL,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500mL,再加入足量锌粉,使之充分反应收集到标准状况下气体2.24 L,过滤残留固体,干燥后并称量,质量减轻了7.5g。
求原硫酸的物质的量浓度。
※ 说明:本题仅为有余力的同学准备的,不记入总分。
1.(1)用过量的锌与浓硫酸反应,某同学认为除生成S02外,还有氢气产生,
理由是
⑵ 用过量的铜片与0.2 mol浓硫酸共热足够长时间,甲同学认为SO2少于0.1 mol,理由是
而乙同学认为产生的SO2为0.1 mol,理由为
由此判断 (填“甲”或“乙”)说得更有道理.
2.如图是一套检验气体性质的实验装置图。向装置中缓慢通入气体X,若关闭活塞K,则品红试液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红试液褪色。X和Y可能是( )
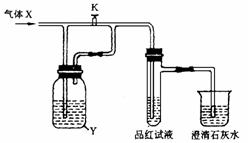
A.SO2、Na2SO3 B.CO2、Na2SO3
C.SO2、Na2CO3 D.Cl2、Na2CO3
3.3.84g铜和一定量某浓度的HNO3反应,当铜反应完毕时,共收集到气体的体积为0.896L (标准状况下).
求: (1)反应中消耗硝酸的总物质的量.
(2)把收集到气体的集气瓶倒立于足量水中,通入多少升标准状况下的氧 气,可以使集气瓶充满溶液?试通过计算回答.
高 一 化 学 试 题 参考答案
1.A2.C3.A4.A5.B 6.A 7.C8.C 9.C10.C11.AB12.C 13.A14.BC 15AC 16.A 17.D18.AC 19B 20.C
21.答案:(1)B (2) C (3)BE (4)C (5)BD
22答案:⑴C 2H2S04(浓)  CO2 2SO2↑ 2H2O (2) ④②①③ CO2 2SO2↑ 2H2O (2) ④②①③
(3)验证产物气流中S02;将S02全部氧化吸收;确认产物气流中SO2已被B瓶溶液全部吸收
(4)无水CuSO4(或变色硅胶);水蒸气;由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之前
(5)澄清石灰水;C02
23.(1)S H2SO3 H2SO4 SO2 BaSO3 BaSO4
(2)H2SO3 Cl2 H2O === 2HCl H2SO4
(3)SO42- Ba2 === BaSO4↓
24.1.94 t
25.

1.(1)由于锌过量,随着反应的进行,浓硫酸变稀,稀硫酸可与锌反应产生H2
(2)根据反应Cu 2H2S04(浓)  CuSO4 SO2↑ 2H2O 可知.当0.2 mol H2S04 全部反应时,才生成0.1mol,而随着反应的进行,浓硫酸变稀,稀硫酸不与Cu反应, 所以产生的SO2少于0.1mo l;加热时间足够长,水被蒸发,硫酸难挥发,因此硫酸始终保持较高的浓度,直到与Cu反应完全为止; 乙 CuSO4 SO2↑ 2H2O 可知.当0.2 mol H2S04 全部反应时,才生成0.1mol,而随着反应的进行,浓硫酸变稀,稀硫酸不与Cu反应, 所以产生的SO2少于0.1mo l;加热时间足够长,水被蒸发,硫酸难挥发,因此硫酸始终保持较高的浓度,直到与Cu反应完全为止; 乙
2.C D
3.
|