| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
三、填空题:(共分) 21、漂白粉的有效成份为 ,工业上制备漂白粉的化学方程式为 ,其中氧化产物为 ,还原产物为 ,氧化剂与还原剂的质量比为 。若将漂白粉投入一含少量CO2和水蒸气的密闭玻璃容器内,并且不断用强光充分照射。最终容器内剩余的固体为 ,气体为 。 22、已知物质A、B、C、D、E、F在一定条件下的关系如图所示,该六种物质的焰色反应均呈黄色。 ⑴写出有关物质的化学式
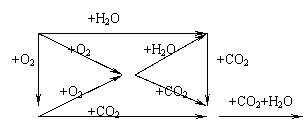
A D A B C C D B E F E F 。 ⑵A、B、C、D四种物质分别长期暴露在空气中,其最终产物为 , 其中变质过程中有氧化还原反应发生的是 。将C加入CuSO4溶液中,发生的反应的离子方程式为 。 23、在t℃时某NaOH饱和溶液的质量分数为a%,密度为ρg/cm3,则此饱和溶液的物质的量浓度为 ,t℃时NaOH的溶解度为 ,此溶液中Na 与H2O的个数比为 。 24、欲除去下列各物质中的少量杂质(括号内是杂质),将所需试剂或操作方法、实验现象或结论填入下表:
| 混合物
| 试剂或方法
| 实验现象或结论
| NaOH溶液(Na2CO3)
|
|
| NaCl固体(I2)
|
|
| Na2CO3固体(NaHCO3)
|
|
| FeSO4溶液(CuSO4)
|
| |
25、在溴水中加入适量镁粉后充分反应,将反应后的溶液分为二份。第一份中加入氯水和四氯化碳,振荡,产生的现象为 ,发生反应的离子方程式为 ;第二份中加入烧碱溶液,反应现象为 ,反应的离子方程式为 。
26、某固体混合物可能由KCl、K2SO4、KI、NaNO3、CuCl2、CaCl2和Na2CO3中的一种或几种混合而成,为鉴定其组成依次进行如下实验:
⑴ 混合物中加入足量水得一无色透明溶液
⑵ 上述溶液中滴加BaCl2有白色沉淀产生,将沉淀滤出并将滤液分成两份
⑶ 上述白色沉淀加盐酸时,沉淀部分溶解
⑷ 向一份滤液中加氯水及CCl4振荡静置CCl4层浅黄绿色
⑸ 往另一份滤液中加AgNO3溶液有白色沉淀产生,该沉淀不溶于HNO3
根据以上实验可判断:
①肯定存在的物质有 ,
肯定不存在的物质有 ,
可能存在的物质有 。
②写出有关反应的离子方程式:
四、实验题(共分)
27、为了证明干燥氯气无漂白性以及卤素氧化性的强弱,可先制取氯气再进行性质实验。下图为实验所提供的仪器和药品,由此回答下列问题:
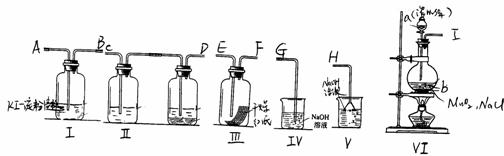
⑴各仪器装置连接的顺序为(填接口序号)
接 、 接 、 接 、 接 、
⑵装置Ⅰ中的现象是 。
装置Ⅰ中发生反应的化学方程式为
装置Ⅳ中发生反应的化学方程式为
⑶仪器a、b的名称分别为 、 。
仪器Ⅱ中分别加入的试剂为 和 (按先后顺序填),其作用分别为 。
五、计算题:
28、取含MnO2的软锰矿石27.86g跟足量浓盐酸反应(杂质不参与反应),制得5.6LCl2(标准状况),求
(1)这种软锰矿石中MnO2的百分含量?
(2)被氧化的HCl为多少g?
29、将28.85gNaCl、KBr和CaCl2的混合物溶于水中,通入足量Cl2充分反应,然后将溶液蒸干灼烧,残留固体的质量为24.4g,若将残留固体溶于水并加入足量Na2CO3溶液,所得沉淀的质量为10g,求:原混合物中各物质的质量。
【参考答案】
一、二选择题:
1.C 2.A 3.D 4.B 5.B 6.B 7.C 8.A 9.C 10.A 11.BC 12.B 13.BC 14.C 15.BD 16.C 17.C 18.AC 19.A 20.D
三、填空题
21. Ca(ClO)2 , 2Cl2 2Ca(OH)2=CaCl2 Ca(ClO)2 2H2O
Ca(ClO)2, CaCl2, 1:1 , CaCl2, CO2、O2
22. (1)Na Na2O Na2O2 NaOH Na2CO3 NaHCO3
(2) Na2CO3, Na、Na2O2, 2Na2O2 2H2O 2Ca2 = 2Ca(OH)2↓ O2↑ 4Na
23. ![]() ,
, ![]() ,
, ![]()
24.
混合物
试剂或方法
实验现象或结论
Ca(OH)2
加热
加热
Fe
25. CCl4层变橙红色, Cl2 2Br-=Br2 2Cl-, 有白色沉淀生成, Mg2 2OH-=Mg(OH)2↓
26.(1)K2SO4 Na2CO3 , KI, CaCl2 ,CaCl2 NaNO3, KCl
(2)Ba2 SO42-=BaSO4↓ Ba2 CO32-=BaCO3↓
BaCO3 2H =Ba2 H2O CO2↑ Ag Cl-= AgCl↓
27.(1)I接C、D接E、F接A、B接G。(或IABCDEFG)
(2)变蓝
Cl2 2KI=2KCl I2
Cl2 2NaOH=NaCl NaClO H2O
(3) 分液漏斗、圆底烧瓶。
饱和食盐水和浓硫酸,除去HCl, 干燥
五、计算题:
28.解:MnO2 4HCl(浓)=MnCl2 Cl2↑ 2H2O
87 2×36.5 22.4L
m1 m2 5.6L
m1=21.75g m2=18.25g
MnO2%= ![]()
29. 解:2KBr Cl2=2KCl Br2 △m
2×119 2(80-25.5)
m1 28.85g-24.4g
m1=11.9g
m(CaCl2)= ![]() 111g/mol=11.1g
111g/mol=11.1g
m (NaCl) =28.85g-11.9g-11.1g=5.85g
| |