|
碳 族 元 素
一、选择题(本题共20小题,每小题3分,共60分。每小题有只有一个选项符合题意)
1. 用于汽车或火车车窗上的玻璃是 ( )
A. 普通硬质玻璃 B. 铅玻璃 C. 钢化玻璃 D. 玻璃钢
2.石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨 ( )
A.有放射性 B.易燃、易爆 C.能导电 D.有剧毒 (MCE00)
3. 下列气体不会造成大气污染的是 ( )
A. NO2 B. SO2 C. CO2 D. Cl2
4. 下列化合物中最容易脱水的是 ( )
A. NaOH B. Mg(OH)2 C. Al(OH)3 D. H4SiO4
5. 在人类已知的化合物中,品种最多的是 ( )
A. 过渡元素的化合物 B. 第二主族元素的化合物
C. 第三主族元素的化合物 D. 第四主族元素的化合物
6. 为防止吸入氯气而引起中毒,可用浸透某种物质溶液的毛巾捂着口鼻, 这种物质可能是 ( )
A. Na2CO3 B. KI C. SO2 D. 浓氨水
7. 在制玻璃、制皂、造纸、纺织等工业生产中都需要的物质是 ( )
A. 氧化钙 B. 纯碱 C. 石灰石 D. 氯化钠
8. 将二氧化碳通入下列溶液中,不能发生反应的是 ( )
A. CaCl2 B. Na2CO3 C. Na2SiO3 D. NaAlO2
9. 光纤通信是一种现代化的通信手段,制造光导纤维的主要原料是 ( )
A. CaCO3 B. CaO C. SiO2 D. Na2CO3
10. 欲制备干燥的CO2,所需的药品是 ( )
A. 碳酸钙、盐酸、浓硫酸 B. 碳酸钙、浓硝酸、生石灰
C. 碳酸钙、浓硫酸、氢氧化钠(固体) D. 碳酸钙、盐酸、碱石灰
11. 下列各组物质混合后能发生反应,但无明显现象的是 ( )
A. Na2SO3溶液与盐酸 B. 过量CO2与石灰水
C. NaOH溶液与NaAlO2溶液 D. NaOH溶液与NaHCO3溶液
12.石灰在工农业生产和建筑业上有着重要用途。用于生产石灰的主要原料是石灰石(用①表示),在石灰窑中加热焙烧石灰石得到生石灰(用②表示)并放出气体(用③表示)。生石灰在建筑业上主要用作粘合剂,一般先使它“熟化”变成熟石灰(用④表示),熟石灰与砂子混合成灰泥用于砌筑砖墙。经过一段时间后灰泥中的熟石灰变成另一固体物质(用⑤表示)。用下列化学式表示这5种物质都正确的是 ( )
A.①Ca(OH)2,②CaO,③SO3,④CaSO4,⑤CaSO4(MCE01)
B.①CaO,②Ca(OH)2,③CO,④CaCO3,⑤CaSiO3
C.①CaCO3,②CaO,③CO2,④Ca(OH)2,⑤CaCO3
D.①CaCO3,②CaO,③SO2,④CaSiO3,⑤Ca(OH)2
13. 关于二氧化硅,下列叙述中不正确的是 ( )
A. 二氧化硅晶体是一种原子晶体
B. 二氧化硅不溶于水,也不能跟水起反应生成酸
C. 二氧化硅是一种酸性氧化物,它不跟任何酸发生反应
D. 二氧化硅和二氧化碳在物理性质上有很大差别
14. 有一种固体混合物,把它溶于水时没有沉淀产生,加入浓度为50%的硫酸,有无色、无臭的气体产生。把该固体加热,在试管壁上有液滴产生。则此固体混合物的组成是( )
A. NaHCO3、MgSO4 B. NaHSO3、NaCl
C. Na2CO3·10H2O、CaCl2 D. Na2SO3、MgCl2
15. 关于一氧化碳的叙述,不正确的是 ( )
A. 一氧化碳能跟人体血液里的血红蛋白化合,故有剧毒
B. 一氧化碳可夺取氧化铜的氧,故具有氧化性
C. 一氧化碳可在炼钢反应中产生,因为C+FeO=CO+Fe
D. 一氧化碳可由二氧化碳还原制得
16. 在糕点类食品的制作过程中,常需加入一定条件下能放出气体从而使糕点疏松的“膨化剂”。下列物质中,适宜用作糕点“膨化剂”的是 ( )
A. CaCO3 B. (NH4)2CO3 C. NaHCO3 D.NH4Cl
17.质量相等的两份气体样品,一份是CO,另一份是 CO2,这两份气体样品中,CO与CO2所含氧原子的原子个数之比是 ( )
A.1∶2 B.1∶4 C.11∶14 D.11∶28(MCE01春)
18.当今化学界关注的热点之一的C60,它可以看成是金刚石的 ( )
A.同素异形体 B.同分异构体 C.同位素 D.同系物
19. 当空气与CO2按5∶1体积比混合的气体与足量灼热的焦炭充分反应后, 若反应的生成物全部是CO,则CO占反应后气体总体积的百分数最接近的是( 气体体积均在同温同压下测定) ( )
A. 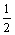 B. B. 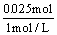 C. C. 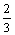 D. D. 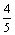
20. 据报导,国外有科学家用激光将置于铁室中石墨靶上的碳原子炸松,与此同时再用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜。据称这种化合物可能比金刚石更坚硬。其原因可能是 ( )
A. 碳、氮原子构成网状结构的晶体
B. 碳氮键比金刚石中的碳碳键更强
C. 氮原子最外层电子数比碳原子最外层电子数多
D. 碳、氮的单质化学性质均不活泼
二、填空题(本题包括7小题,共30分)
21. (4分)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,其产生碱性的原因是(用离子方程式表示)_______________________________________;施加适量石膏可降低盐碱地的碱性,表示其反应原理的离子方程式是_________________________________________。
22. (8分)称取一定质量的含不同杂质的纯碱溶于水后与适量盐酸反应, 跟同质量不含杂质的纯碱相比(填多或少)
⑴ 若纯碱中含小苏打,则盐酸用量_____,产生气体的量______;
⑵ 若纯碱中含碳酸钾,则盐酸用量_____,产生气体的量______;
⑶ 若纯碱中含氯化钠,则盐酸用量_____,产生气体的量______;
⑷ 若纯碱中含碳酸氢钙,则盐酸用量_____,产生气体的量______。
23. (3分)将50 mL 0.1 mol / L的氢氧化钠溶液和5 mL 0.5 mol / L的乙酸溶液混合蒸干并强热,最终得到的固体是______________,得到此固体的最后化学方程式是:__________________________________________。
24.(7分)物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀;E是白色固体。A、B、C、D、E间的转化如右图,根据图示关系回答:
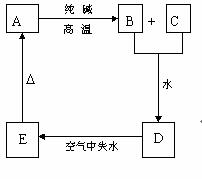
⑴ 分子式A________,B________,C________,D________,E________;
⑵ 请写出变化中的有关化学方程式:
① B+C ─→ D:_________________________________________________;
②E  A:______________________________________________________。 A:______________________________________________________。
25. (4分)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止。则在此过程中碳酸氢根离子浓度变化趋势可能是:(A)逐渐减少,(B)逐渐增大,(C)先逐渐增大,而后减小,(D)先逐渐减小,而后增大。你的选择是________(填正确选项的标号)。试用化学方程式和简要文字表述其理由。
_________________________________________________________________________
_________________________________________________________________________。
26. (2分)取一定量NaHCO3和NH4HCO3分别加热到300℃使之完全分解, 在该温度和相同压强下收集到的气体体积之比是1∶6,则原来NaHCO3和NH4HCO3的物质的量之比是_____。
27. (4分)120℃时,将2 L H2O、1 L CO、1 L O2和2 L CO2组成的混合气体依次缓慢通过装有过量炽热铜粉,过量过氧化钠和过量炽热炭粉的三个反应管,经充分反应后得到的气体是______________。恢复到原来浓度和压强,其体积为_______________L。
三、选择题(10分)
28. 含有SiO2的石灰石5 g,与60 mL 2 mol / L的盐酸反应,得到1.064 L二氧化碳( 标准状况)。要中和剩余的盐酸需 1 mol / L的NaOH溶液多少毫升?煅烧这种不纯的石灰石1 t,能得到多少千克不纯的生石灰?这种生石灰的纯度是多少?
答 案
1.C 2.C 3.C 4.D 5.D 6.A 7.B 8.A 9.C 10.A 11.D 12.C 13.C 14.A 15.B 16.C 17.C 18.A 19.A 20.B
21. (每空2分)  +H2O +H2O  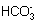 +OH- ; Ca2 + +OH- ; Ca2 + 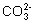 =CaCO3↓ =CaCO3↓
22. (每空1分)⑴少; 多 ⑵少; 少 ⑶少; 少 ⑷少; 多
23. Na2CO3(1分); CH3COONa+NaOH 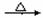 Na2CO3+CH4↑(2分) Na2CO3+CH4↑(2分)
24. (每空1分)⑴SiO2; Na2SiO3; CO2; H4SiO4; H2SiO3 ⑵ ①Na2SiO3+CO2+2H2O=Na2CO3+H4SiO4 ②H2SiO3  SiO2+H2O SiO2+H2O
25. (每空2分)C; 因为Na2CO3=2Na + 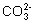 , , 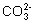 +H +H  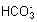 , 所以溶液中 , 所以溶液中 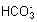 浓度逐渐增大,又因为 浓度逐渐增大,又因为 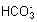 +H =H2CO3,H2CO3=H2O+CO2↑(或因为 +H =H2CO3,H2CO3=H2O+CO2↑(或因为 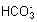 +H =H2O+CO2↑),所以溶液中 +H =H2O+CO2↑),所以溶液中 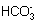 浓度减少。 浓度减少。
26.(2分)1∶2
27.(每空2分)CO; 5
28. n (CO2) = 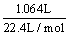 = 0.0475 mol (1分) = 0.0475 mol (1分)
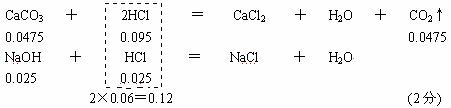
⑴V(NaOH) = 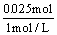 = 0.025 L =25 mL (1分) = 0.025 L =25 mL (1分)
⑵解一:m (CO2) = 0.0475 mol×44 g / mol = 2.09 g (1分)
不纯的生石灰为1000 kg× 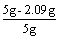 =582 kg (1分) =582 kg (1分)
解二:m (CO2) =1000 kg× 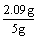 =418 kg (1分) =418 kg (1分)
不纯的生石灰为1000 kg-418 kg =582 kg (1分)
⑶ 解一:总生石灰为56 g / mol×0.0475 mol =2.66 g (1分)
SiO2为5 g-2.09 g-2.66 g = 0.25 g (1分)
0.25 g SiO2消耗CaO为 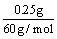 ×56 g / mol = 0.23 g (1分) ×56 g / mol = 0.23 g (1分)
剩余不纯生石灰为5 g-2.09 g = 2.91 g
CaO% = 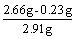 ×100% = 83.4% (1分) ×100% = 83.4% (1分)
解二:总生石灰为 1000 kg× 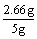 =532 kg (1分) =532 kg (1分)
m (SiO2) =1000 kg-532 kg-418 kg =50 kg (1分)
SiO2消耗CaO 50 kg× 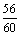 = 46.7 kg (1分) = 46.7 kg (1分)
CaO% = 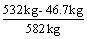 ×100%=83.4% (1分) ×100%=83.4% (1分)
|