|
高一化学上册期中调研试题
化 学
注意事项:
1.本卷总分100分,考试时间75分钟。
2.第I卷选择题答案填在选择题答案栏内。
3.可能用到的相对原子质量:
H∶1 C∶12 O∶16 S∶32 Na∶23 N∶14 Cl∶35.5 Ba∶137
第Ⅰ卷 选择题(共54分)
一、选择题(本题包括8小题,每小题3分,共27分。每小题只有一个选项符合题意。)
1. 下列说法中正确的是( )
A.区别胶体与溶液的最简单的方法是丁达尔效应
B.胶体中分散质粒子直径小于1×10-9m
C.往NaOH溶液中滴入FeCl3溶液立即可制得胶体
D.清晨的阳光穿过茂密的树木枝叶所产生的美丽景象(美丽的光线)是由于胶体粒子对光线的反射形成的。
2.下列仪器不可用于物质分离的是
A.三角漏斗 B.蒸馏烧瓶
C.分液漏斗 D.容量瓶
3.下列说法正确的是
A.摩尔是一种国际基本物理量
B.标准状况下气体摩尔体积约为22.4L
C.1mol氧的质量为16g
D.在同温同压下,相同体积的任何气体单质所含分子数相同
4.下列各组物质分离的方法不正确的是
A.碘水中的碘用萃取分液方法 B.水和酒精用分液的方法
C.用蒸馏的方法制蒸馏水 D.水中的硫酸钡用过滤的方法除去
5.下列有关0.1 mol·L-1 NaOH 溶液的叙述正确的是
A.1L该溶液中含有NaOH 40g
B.100ml该溶液中含有OH— 0.01mol
C.从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol·L-1
D.在1L水中溶解4g NaOH即可配制得0.1 mol·L-1 NaOH 溶液
6.下列化学反应能用H OH— = H2O表示的是
A.NaOH溶液和醋酸溶液的反应 B.Ba(OH)2溶液和稀H2SO4的反应
C.氨水和稀H2SO4的反应 D.NaOH溶液和盐酸反应
7.下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是
A.150 mL 3 mol·L-1的KCl O3 B.75 mL 2 mol·L-1的NH4Cl
C.350 mL 3 mol·L-1的NaCl D.150 mL 2 mol·L-1的CaCl2
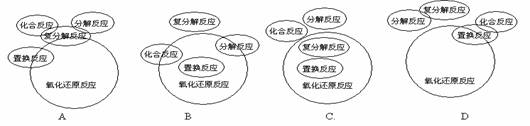
8.化合反应、分解反应、置换反应、复分解反应与氧化还原反应的交叉分类示意图正确的是
9.在2KMnO4 16HCl===2KCl 2MnCl2 5Cl2↑ 8H2O反应中,被氧化与被还原元素的物质的量之比为
A.1∶8 B.2∶5 C.5∶1 D.1∶5
二、选择题(本题包括9小题,每小题3分,共27分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得3分,但只要选错一个,该小题就为0分)
10.用NA表示阿伏加德罗常数,下列有关说法正确的是
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1mol氦气含有的原子数为NA
C.71gCl2所含原子数为2 NA
D.23g钠在化学反应中失去电子数目为10 NA
 11. 下列电离方程式中,正确的是( ) 11. 下列电离方程式中,正确的是( )
A.NaHCO3=Na H CO32- B.NaHSO4 Na HSO4-
C.H2SO4=2H SO42- D.KClO3=K Cl- 3O2-
12.下列实验操作中错误的是
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
13.在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的 
14.下列反应中氯元素被氧化的是
A.5Cl2+I2+6H2O=10HCl+2HIO3 B.Cl2+H2=2HCl
C.MnO2+4HCl=MnCl2+2H2O+Cl2↑
D.2NaCl+2H2O  2NaOH+Cl2↑+H2↑ 2NaOH+Cl2↑+H2↑
15.在某无色透明的酸性溶液中,能共存的离子组是
A.K+、Mg2 、NO3-、Cl- B.Ca2+、Na+、CO32-、 OH-
C.Fe3 、K 、SO42-、Cl- D.Mg2+、K+、 CO32-、 SO42-
16.下列离子方程式正确的是
A.铁和盐酸反应:2Fe 6H ==2Fe3 3H2↑
B.碳酸氢钠溶液中加入足量的石灰水:2 HCO3— Ca2+ 2 H == CaCO3↓ CO32— 2 H2O
C.碳酸钙溶于稀醋酸中CaCO3+2H = Ca2 +H2O+CO2↑
D.氢氧化钡溶液与盐酸的反应OH— + H == H2O
17.对于相同物质的量的SO2和SO3,下列说法中正确的是
 A.硫元素的质量比为5∶4 B.分子数之比为1∶1 A.硫元素的质量比为5∶4 B.分子数之比为1∶1
C.原子总数之比为4∶3 D.质量之比为1∶1
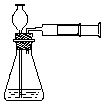
18.实验室实验时也可用推拉注射器活塞的方法检查右图中装置的气密性。当缓慢向外拉活塞时,如果装置气密性良好,可能观察到
A.长颈漏斗下端口产生气泡 B.瓶中液面明显上升
C.长颈漏斗内的液面上升 D.注射器内有液体
高一化学期中考试化学试题答题卷
选择题答案
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
题号 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
答案 |
|
|
|
|
|
|
|
|
|
第II卷 非选择题(共46分)
三、概念的理解与解答题(本大题共3小题,共14分)
19.(4分)1.2gRSO4中含0.01molR2 ,则RSO4的摩尔质量是 ;R的相对原子质量是 。
20.(6分)写出下列反应的离子方程式:
(1)FeCl3溶液中加入NaOH溶液:
(2)碳酸钠溶液与足量稀盐酸混合:
(3)氢氧化钡溶液与稀硫酸混合:
21.(4分)从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强.
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,___________原子还原性最强;Cu2+、Fe2+、Ag+中,_______________离子氧化性最强。
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2)。则氯气分子、氯离子、氢离子中_____________具有氧化性,___________氧化性最强。
四、实验探究与巩固题(本大题共3小题,共26分)
22.(9分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)粗盐溶解,过滤后除去的杂质是 。
(2)如何运用最简方法检验溶液中有无SO42-离子? 。如果有,应该如何除去SO42-离子? 。
(3)在经过操作(2)后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是 。
(4)将经过操作(3)后的溶液过滤。请问这一操作能除掉哪些杂质?
。
(5)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ;②固定铁圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热。其正确的操作顺序为 。
(6)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时: 。
过滤时: 。
蒸发时: 。
23.(12分)用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4,请按要求填空:
(1)所用浓H2SO4的物质的量浓度为 ,配制时所需浓硫酸的体积为 。
(2)如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒,实验中还需要用到的仪器有 。
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容 ;
②定容时俯视刻度线 ;
(4)若定容时液面高于刻度线应采取的措施是 。
24.(5分)某学校课外兴趣小组做如下实验探究胶体的性质,请你就得到的现象做合理的解释:
(1)在一洁净的试管中加入4-5ml水,用激光笔照射 (填能或不能)看见光亮的通路,
(2) 再在上述试管中加入一小块泥土,用玻璃棒搅拌后并用激光笔照射,未见丁达尔现象,
(3) 继续将上述试管静置片刻后,用激光笔从试管口垂直往下照射,从侧面观察,试管上部并未出现丁达尔现象,中部看到了丁达尔现象,下部未出现丁达尔现象
请你对该现象作一合理解释
.
五、计算与能力题(本大题共1小题,6分)
25.(6分)取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用足量的稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算(请写出计算过程,没有过程不得分)
(1)原混合液中Na2SO4的物质的量浓度。
(2)产生的气体在标准状况下的体积。
(3)过滤出沉淀后,计算所得滤液溶质的物质的量浓度(不考虑硝酸)(设反应前后溶液的密度均为1g·cm-3,反应前后溶液体积变化忽略不计)。
高一化学期中考试化学试题参考答案
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
答案 |
A |
D |
D |
B |
B |
D |
C |
B |
C |
|
题号 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
答案 |
BC |
C |
AD |
A |
CD |
A |
D |
B |
A |
19.120g/mol ;24 (各2分,共4分)
20.(1)Fe3 3OH— == Fe(OH)3↓
(2)CO32— 2H == H2O CO2↑
(3)Ba2 2OH— 2H SO42— == BaSO4↓ 2H2O
(各2分,共6分)
21.答案:(1)Fe Ag+ (2)H+、Cl2;Cl2 (各1分,共4分)
22.(1)泥沙等固体不溶物
(2)静止片刻在上层清液处,滴加一滴BaCl2溶液,如果出现白色浑浊或者沉淀,则溶液中有SO42-,不出现浑浊就说明SO42-已经除尽。除去SO42-的方法是在溶液中加入过量的BaCl2溶液。
(3)除去Ca2 、Mg2 以及加入过量Ba2
(4)BaSO4、CaCO3、MgCO3、BaCO3等杂质
(5)①②③④⑤
(6)搅拌,加速溶解;使待滤液体沿玻璃棒流入漏斗,防止外洒;搅拌,防止因局部过热液滴或晶体飞溅。 (各1分,共9分)
23.(1)18.4mol/L 13.6mL (各2分,共4分)
(2)20 烧杯、玻璃棒、胶头滴管、500mL容量瓶 (各1分,共5分)
(3)偏高;偏高 (各1分,共2分)
(4)重新配制 (1分)
24.(1)不能 (2分)
(3)上部是溶液,微粒直径小于1nm,中部微粒直径介于1nm~100nm,下部是浊液,微粒直径大于100nm (3分)
25.(1)0.2mol/L
(2)1.12L
(3)c(NaNO3)==0.7mol/L (各2分,共6分)
|