|
可能用到的原子量:H = 1 C = 12 N = 14 O = 16 Na = 23 Al = 27 S =32 Cl = 35.5 K = 39 Ca = 40 Zn = 65 Ba = 137
第Ⅰ卷(选择题,共65分。)
一.选择题:(本题有13个小题,每小题有1或2个选项符合题意,每小题5分,共65分。)
AUTONUM 1.下列叙述中,正确的是 ( )
A.H2SO4的摩尔质量是98
B.等质量的O2和O3中所含的氧原子数相同
C.等质量的CO与CO2中所含碳原子数之比为11︰7
D.将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L
AUTONUM 2.在无色强酸性溶液中,下列各组离子能够大量共存的是…………..…...…..( )
A.Cl -、Na 、NO3-、Ca2 B.NH4 、HCO3-、Cl-、K
C.K 、Ba2 、Cl-、SO42- D.Cu2 、NH4 、I-、Cl-
AUTONUM 3.下列化学方程式中,不能用H++OH-=H2O表示的是( )
A 2NaOH+H2SO4=Na2SO4+2H2O
B Ba(OH)2+2HCl=BaCl2+2H2O
C Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
D KOH+HCl=KCl+H2O
AUTONUM 4.下列各组中的离子,能在溶液中大量共存的是( )
A H+ Na+ CO32- Cl- B Ba2+ Na+ Cl- SO42-
C K+ H+ SO42- OH- D Ag+ Al3+ NO3- H+
AUTONUM 5.设 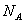 为阿伏加德罗常数,下列说法中正确的是( ) 为阿伏加德罗常数,下列说法中正确的是( )
A.1 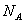 个氢气分子所占的体积为22.4L 个氢气分子所占的体积为22.4L
B. 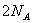 个二氧化碳分子的质量为44g 个二氧化碳分子的质量为44g
C.1000mL0.1mol/L 的NaCl溶液中, 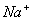 与 与 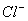 离子总数为 离子总数为 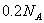
D.17g氨气中所含原子数为 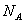
AUTONUM 6.下列反应中,离子方程式书写正确的是( )
A.氢氧化钡与盐酸反应: OH— H =H2O
B.Fe和盐酸反应:2Fe+6H =2Fe3 +3H2↑
C.Cu和AgNO3溶液反应:Cu+Ag =Cu2 +Ag
D.石灰石和盐酸反应:CaCO3+2H =Ca2 +CO2↑+H2O
AUTONUM 7.下列物质中属于非电解质的是( )
A.NaOH B.O2 C.Na2CO3 D.乙醇
AUTONUM 8.下列叙述正确的是( )
A.1mol任何物质都含有6.02×1023个原子 B.0.012kg12C含有6.02×1023个碳原子
C.硫酸的摩尔质量是98g D.常温常压下,1mol氧气的体积为22.4L
AUTONUM 9.能正确表示下列化学反应的离子方程式是( )
A.氢氧化钡溶液与盐酸的反应OH-+H =H2O
B.澄清的石灰水与稀盐酸反应Ca(OH)2 2H =Ca2 2H2O
C.铜片插入硝酸银溶液中Cu Ag =Cu2 Ag
D.碳酸钙溶于稀盐酸中CaCO3+2H =Ca2 +H2O+CO2
AUTONUM 10.下列可以大量共存且溶液是无色的离子组是( )
A.H 、Na 、NO3-、Cu2+ B.Ba2 、Mg2 、 Cl-、SO42-
C.H 、K 、OH-、NO3- D.NO3-、SO42-、K 、Mg2
AUTONUM 11.对于相同物质的量的SO2和SO3,下列说法中正确的是( )
A.硫元素的质量比为5∶4 B.分子数之比为1∶1
C.原子总数之比为3∶4 D.质量之比为1∶1
AUTONUM 12.下列数量的各物质:①0.5molNH3 ,②标准状况下22.4LHe,③4℃时9mlH2O,④0.2molH3PO4中,所含原子个数由大到小的顺序是( )
A.②③④① B.④③②① C.①④③② D.①④②③
AUTONUM 13.除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④HCl。加入试剂合理的操作顺序是………..( )
A.①②③④ B.③①②④ C.④②①③ D.③②①④
第Ⅱ卷(非选择题,共35分。)
二.(本题包括2小题,共19分。)
AUTONUM 14.(9分)
(1)0.5 mol H2O的质量为 ,其中含有 个水分子,共有 个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 _ ,在相同温度和相同压强条件下,体积最大的是 ,体积最小的是 。
(3)在 mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O ____ g。
(4)中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸溶液的体积比为 。
AUTONUM 15.(10分)某生欲用 2mol/LNaOH溶液配制0.1mol/LNaOH溶液100 mL,请你帮他完成该实验:
⑴该生应该选用的实验仪器有__________ _________________。
(2)实验中所需量取2mol/LNaOH溶液的体积为_______________。
(3)该生把量取的NaOH溶液倒入小烧杯中加水稀释冷却后,转移到容量瓶中,即进行定容、摇匀,得到所需的溶液。该生的操作准确吗?如不准确,请你指出他操作中的错误或缺漏之处:_____________________________________________。
(4)请你说出该生定容操作应采取的具体方法_____________________________。
三.(本题包括2小题,共16分。
AUTONUM 16.(8分)将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)6.50g锌的物质的量;
(2)所用盐酸中HCl中的物质的量浓度;
(3)反应中生成的H2在标准状况下的体积。
17.(8分)使一定质量的锌与100mL18.5mol/L浓硫酸充分反应。
(1)若锌完全溶解,同时生成标准状况下SO2气体3. 36L,求所得溶液中硫酸锌的物质的量浓度(假设反应前后溶液体积保持不变)。
(2)若锌完全溶解,同时生成标准状况下混合气体为33.6L,并将反应后的溶液稀释至1L,测得溶液中c(H )为0.100mol/L,求混合气体中各组分的体积比。
(注:Zn 2H2SO4(浓) 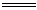 ZnSO4 SO2↑ H2O Zn H2SO4(稀)=ZnSO4 H2↑) ZnSO4 SO2↑ H2O Zn H2SO4(稀)=ZnSO4 H2↑)
高一化学周考试题 答案及评分标准 2008.9.27
选择题每题5分,漏选得3分
1.BC 2.A 3.C 4.D
5.C 6.AD 7.D 8.B 9.AD 10.D
11.BC 12.C 13.D
14.(9分)
(1) 9g 3.01×1023 9.03×1023 (2) CO2 NH3 CO2
(3) 125 2.5 (4) 6︰3︰2(每空1分)
15.(共10分)
(1)(共3分,只对两个不得分,从第三个开始每对一个得1分)10 mL量筒、玻璃棒、100 mL容量瓶、胶头滴管、小烧杯
(2)(2分)5 mL
(3)(3分)不准确;(1分)转移完溶液后应用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也一同转入容量瓶中。(2分)
(4)(2分)向容量瓶中注入蒸馏水至离刻度线1~2 cm处,改用胶头滴管滴加蒸馏水到溶液的 凹液面正好与刻度线相切
16.(8分)解:
(1)6.50g锌的物质的量:
n (Zn)= EQ F(6.5g,65g/mol-1) =0.100mol 2分
(2) Zn 2HCl = ZnCl2 H2
1mol 2mol 22.4L
0.100mol c (HCl) ×0.200L V (H2) 4分
c (HCl)= EQ F(2mol×0.100mol,1mol×0.200L) =1.00mol·L-1 6分
(3)V (H2)= EQ F(22.4×0.100mol,1mol) =2.24L 8分
17.共8分
(1)Zn 2H2SO4(浓) 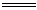 ZnSO4 SO2↑ H2O ZnSO4 SO2↑ H2O
1mol 22.4L
n(ZnSO4) 3.36L
则X n(ZnSO4)=0.150mol(1分), c(ZnSO4)=1.50mol·L-1(3分)
(2)据题意:反应后c(H2SO4)为0.0500mol·L-1,n(H2SO4)为0.0500mol
Zn 2H2SO4(浓) 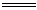 ZnSO4 SO2↑ H2O ZnSO4 SO2↑ H2O
2n(SO2) n(SO2)
Zn H2SO4(稀)=ZnSO4 H2↑
n(H2) n(H2)
 2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1 (4分) 2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1 (4分)
n(SO2) n(H2)= EQ F(33.6L,22.4L·mol-1) (5分)
解得: n(SO2)=0.300mol(6分) n(H2)=1.20mol(7分)
则:V(SO2)∶V(H2)=0.300mol∶1.20mol=1∶4 (8分)
|