| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
AUTONUM 24.下列离子方程式的书写正确的是…………..…………………..………… .…..( ) A.实验室用大理石和稀盐酸制取CO2:2H CO32- = CO2↑ H2O B.铁和稀硝酸反应:Fe 2H = H 2↑ Fe 2 C.向AlCl3溶液中加入过量的NaOH溶液:Al3 3OH- = Al(OH)3↓ D.NaHCO3溶液与NaOH溶液反应: OH- HCO3- = CO32- H2O
结果使澄清石灰水变浑浊,则X、Y可能是…( ) ① H2和NaHCO3磺 ②CO和Na2CO3 ③CO和CuO ④H2和Fe2O3 A. ①② B. ①③ C. ②③ D. ③④ Ⅱ非选择题(共80分) 二、填空题(本题有4小题,共23分) AUTONUM 26.(9分)(1)0.5 mol H2O的质量为 ,其中含有 个水分子,共有 个原子。 (2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 _ ,在相同温度和相同压强条件下,体积最大的是 ,体积最小的是 。 (3)在 mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O ____ g。 (4)中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸(H3PO4)溶液的体积比为 。 27.(4分).实验室制取Cl2的反应方程式为:MnO2 4HCl (浓) 28.(3分)Cl2和SO2都有漂白作用,现将二者以等物质的量混合后再通入到品红溶液中,品红溶液将 (填褪色或不褪色),反应方程式为: ____ 。 29.(7分)(1)正常雨水显 性,其pH约值等于 ,这是由于 ____ 。 (2)某次采集的酸雨样品,每隔一段时间测定一次pH值,得数据如下
| 时间
| 开始
| 8h后
| 16h后
| 24h后
| 32h后
| 40h后
| 48h后
| pH
| 5.0
| 4.8
| 4.6
| 4.3
| 4.2
| 4.0
| 4.0 |
酸雨样品pH值变小的主要原因是 __________
__________ 。
三、实验题(本题有3小题,共23分)
30.(10分)除去下列物质中所混有的少量杂质,指明应加入的试剂和使用的分离方法,写出有关的反应方程式。
(1)铜粉中混有少量铝粉 ;
 (2) FeCl3中混有少量FeCl2 ;
(2) FeCl3中混有少量FeCl2 ;
(3)Na2CO3中混有少量NaHCO3 。
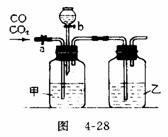
31.(5分)某学生用图4-28的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。
(1)甲瓶内盛 溶液,乙瓶内盛 溶液,分液漏斗内盛 溶液。
(2)实验先分离出一氧化碳,方法是先关闭 ,再打开 。
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭 ,再打开 。
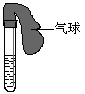 32.(8分)某学生课外活动小组利用右图所示装置分别做如下实验:
32.(8分)某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:___________________________________ ______。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是
。
四、推断题(本题有2小题,共20分)
33.(12分)已知A.B.C.D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色。
③C D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
⑴ 则各是什么物质的化学式为:A 、B 、C 、D 。
⑵现象②中所发生的反应的化学方程式为:
、 。
⑶现象③中所发生反应的离子方程式为:
、 。
\s 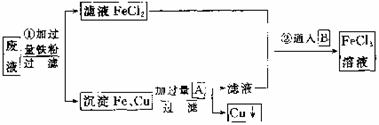 34.(8分)某工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程:
34.(8分)某工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程:
(1)方框内物质A和B的化学式:A ,B 。
(2)根据图示第①步的有关离子方程式为 。
(3)第②步的化学方程式为 。
五、计算题(本题有2小题,共14分)
35.(8分)用适当溶液把3.31 g某铁矿石样品溶解,然后加过量碱溶液,生成沉淀,再灼烧沉淀,得2.40 g Fe2O3。已知该铁矿石中铁的氧化物的质量分数为70%。试计算:
⑴ 该铁矿石中铁的质量分数。
⑵ 该铁矿石中铁的氧化物的化学式。
36.(6分)向1L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,求原溶液中Fe3 的物质的量浓度。
高一化学上学期总复习检测题(一)
参考答案及评分标准
一、(本题共15小题,每小题3分,每小题只有一个正确选项)
1.C 2.A 3.D 4.B 5.B 6.B 7.D 8.B 9.D 10.A 11C
12.D 13.D 14.C 15.D 16.BC 17.B 18.D 19.C 20.C 21.C 22.A 23.B 24.D 25.B
二、填空题(本题有4小题)
26.(1) 9g 3.01×1023 9.03×1023 (2) CO2 NH3 CO2
(3) 125 2.5 (4) 6︰3︰2
AUTONUM 27.氧化剂 酸性 一半盐酸做还原剂,一半盐酸起酸的作用
AUTONUM 28.不褪色(1分) SO2 Cl2 2H2O = 2HCl H2SO4(2分)
AUTONUM 29.(1)酸 5.6 雨水中溶解了CO2
(2)酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,发生的反应为:
2H2SO3 O2 = 2H2SO4
三、实验题(本题有3小题)
AUTONUM 30. (1) NaOH溶液,过滤,2Al 2NaOH 2H2O = 2NaAlO2 3H2↑(或用盐酸、稀硫酸)
(2) 通入Cl2, 2FeCl2 Cl2 =2FeCl3
(3) 加热, 2NaHCO3 ![]() Na2CO3 CO2↑ H2O 31.(5分)
Na2CO3 CO2↑ H2O 31.(5分)
AUTONUM 31.(1) NaOH溶液或碱溶液 浓H2SO4 浓H2SO4
(2) b a (3)(2分) a b
32 .(1) 稀氨水 酚酞的混合溶液 加热时氨气逸出,导致溶液的红色变浅;
(2) 溶有SO2的品红溶液 加热时SO2气体逸出,品红溶液恢复红色。
四、推断题(本题有2小题)
33. (1) (4分)A:BaCl2 B:FeSO4 C:AlCl3 D:NaOH;
(2) FeSO4 2NaOH = Fe(OH)2↓ Na2SO4,
4 Fe(OH)2 O2 2H2O = 4Fe(OH)3
(3) Al3 3OH- = Al(OH)3↓,Al(OH)3 OH- = AlO2- 2H2O
34.(1) HCl Cl2
(2) 2Fe3 Fe = 3Fe2 ,Cu2 Fe = Cu Fe2 ;
(3) 2FeCl2 Cl2 = 2FeCl3
五、计算题(本题有2小题,共14分)
35.解:(1) 铁矿石中铁的质量分数为: ![]()
(2) 铁的氧化物中
n(Fe) : n(O)= ![]()
故铁的氧化物的化学式为Fe3O4
36.解:因为:Fe3 3OH—=Fe(OH)3↓, Al3 3OH—=Al(OH)3↓,
Al(OH)3 3OH—=AlO2— 2H2O 根据物质的量比得:
|
b—a= n(Al3 )
解得:n(Fe3 )]=(4a/3-b)mol/L
| |