|
高一上学期期中考试化学试卷
考生注意:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共100分。考试时间90分钟。
2.请将各卷答案填在试卷后面的答题卷上。
3.本试卷主要考试内容:必修①第一第至第三章第1节。
4.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5
Fe 56 Cu 64
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.下列过程中发生了氧化还原反应的是
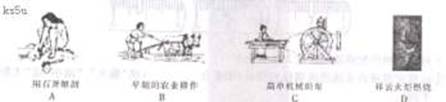
2.向一定量的含Na 、H 、SO42ˉ的溶液巾加入含有下列离子的稀溶液,离子数目不会减少的是
A.Ba2 B.HCO3ˉ C.OHˉ D. Clˉ
3.若A 酸==盐 水,则A不可能属于
A.氧化物 B.单质 C.碱 D.电解质
4.胶体区别于溶液、浊液的性质在于
A.能发生丁达尔效应 B.能用肉眼将胶体与溶液、浊液区别开来
C.均一、稳定、透明 D.分散质会因重力作用而沉降
5.空气中的自由电子附着在分子或原子上形成的空气负离子(也叫阴离子)被称为“空气维生素”。O2ˉ就是一种空气负离子,其摩尔质量为
A.32 g B.33 g C.32 g·molˉ1 D.33 g·molˉ1
6.在实验室中,用镊子从煤油中取出一小块金属钠,然后用滤纸将煤油吸干,再用小刀切开观察。在这一实验过程中不能得出的钠的物理性质是
A.钠在常温下是固体 B.钠具有银白色的金属光泽
C.钠的熔点很低 D.金属钠很软
7.下列各组混合物中,能用分液漏斗分离的是
A.酒精和水www.ks5 u.com B.植物油和水
C.汽油和柴油 D.碘和四氯化碳
8.下表是某矿物质饮用水的部分标签说明

则该饮用水中还可能较大量存在
A.OHˉ B.Ag C.Na D. Ca2
9.常温常压下,用等质量的CH4、CO2、O2、SO2 (五分别吹出四个气球,其中气体为CH4的是

10.下列关于铁与水蒸气发生反应的说法中不正确的是
A.反应中有氢气产生
B.此反应需在高温下才能发生
C.生成的铁的化合物中铁全部呈 3价
D.该反www.ks5 u.com应中水作氧化剂
 11.下图锥形瓶中装满了c mol·Lˉ1的Na2SO4溶液,经测定其中含有a mol SO42-,则锥形瓶容积为 11.下图锥形瓶中装满了c mol·Lˉ1的Na2SO4溶液,经测定其中含有a mol SO42-,则锥形瓶容积为
A.  L B. L B. 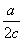 L C.acL D.2acL L C.acL D.2acL
12.欲除去铁粉中混有的少量铝粉,应选用的试剂是
A.稀盐酸 B.新制的氯水 C.烧碱溶液 D.纯碱溶液
13.铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质
间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反
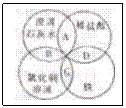 应,其中对应反应的离子方程式书写正确的是 应,其中对应反应的离子方程式书写正确的是
A.OHˉ HCl == H20 C1ˉ
B.Ca(OH) 2 Cu2c == Ca2 Cu(OH) 2
C.Fe Cu2 == Cu Fe2
D.Fe 2H == Fe3 H2↑
14.同温同压下,14 g气体M所占的体积和1 g H!所占的体积相同,则气体M的相对分子质量为
A.14 B.28 C.42 D.56
15.制备单质硅的主要化学反应如下:
①SiO2 2C  Si 2CO↑ ②Si 2Cl2 Si 2CO↑ ②Si 2Cl2  SiCl4 ③SiCl4 2H2 SiCl4 ③SiCl4 2H2  Si 4HCl Si 4HCl
下列对上述三个反应的叙述中不正确的是
A.①③为置换反应 B.①②③均为氧化还原反应
C.⑧中SiCl4是氧化剂 D. 三个反应的反应物中的硅元素均被还原
16.称取两等份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱。若同温同压下放出相同体积的气体,则消耗HCI和NaOH的物质的量之比为
A.1:1 B.2:3 C.3:2 D. 3:1
第Ⅱ卷 (非选择题共52分)
二、非选择题(本题包括5小题,共52分)
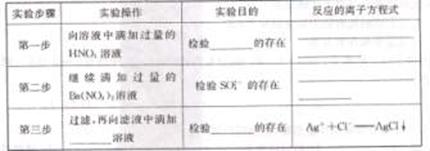
17.(12分)某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中的三次检测结果如下表所示,请回答下列问题:

(1)三次检测结果巾第 次的检测结果肯定不正确
(2)在检测时,为了确定溶液中是否存在SO42-、CO32-和Cl-,该小组同学进行了如下实验,
请你参与探究与分析。
 18.(12分)右图为一“铁链”图案,小明在图案上分别写了 18.(12分)右图为一“铁链”图案,小明在图案上分别写了
H2、CO2、Na2 O、NaCl、FeCl3五种物质,图中相连的两
种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
(1)请将分类依据代号填人相应的括号内:
( )两种物质都不是电解质
( )两种物质都是钠的化合物
( )两种物质都是氧化物
( )两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol·L-的上图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为 。
②证明有红褐色胶体生成的实验操作是 。
 19.(12分)某同学帮助水质检测站配制480 mL0.5mol·L- NaOH 溶液以备使用 19.(12分)某同学帮助水质检测站配制480 mL0.5mol·L- NaOH 溶液以备使用
(1)该同学应选择 mL的容量瓶。
(2)其操作步骤如下图所示,则右图操作应在下图中
(填选项字母)之间。

A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体 g,用质量为23.1g的烧杯放在托盘天平上称取所需
NaoH固体时,请在附表中选取所需的砝码大小 (填字母),并在下图中选出能正确表示游码位置的选项 (填字母)。

(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会 (填“偏大”、“偏小”或无影响,下同)
②容量瓶中原来有少量蒸馏水,浓度会 。
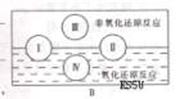
20.(9分)(1)A图是课本中“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2 CuO  Cu H3O所属的区域。 Cu H3O所属的区域。

(2)“四种基本反应类型与氧化还原反应的关系”也可用B图表达。其中I为化合反应,则Ⅱ为 反应。写出有水生成的符合反应类型III的一个化学方程式: 。写出有水参加的符合反应类型IV的一个化学方程式:
,其中水为 剂。
21.(7分)在500mL 1 mol·L-CuSO溶液中放入一块铁片,反应片刻后,生成1.6g Cu求:
(1)参加反应的铁的质量
(2)若反应后,溶液的体积仍为500mL,则溶液中FeSO4的物质的量浓度是多少?
参考答案
1.D 2.D 3.B 4.A 5.C 6.C 7.B 8.C 9.D 10.C 11.A 12.C 13.C 14.B 15.D 16.D
17.(1)二
(2)

(每空2分)
18.(1)A;C;B;D
(2)①FeCl3
②用一束光照射烧杯巾的液体,若能产生丁达尔效应,则证明生成了Fe(OH) 3胶体
(每空2分)
19.(1)500(1分)
(2)C(2分)
(3)10.0 (2分);cd(2分);c(1分)
(4)①偏小
②无影响(各2分)
20.(1) 
(2)分解;NaOH Hcl==NaCI H20;C H20  C0 H2;氧化(其他合理答案也可) C0 H2;氧化(其他合理答案也可)
(各2分)
21.(1)1.4 g(3分)
(2)c(FeSO4)=0.05 mol·L- (4分) 提示:(1)设参加反应的Fe有x g .
根据反应:Fe CuS04==Cu FeS04
56 g 64 g
z g 1.6 g
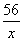 ,解得x=1.4 ,解得x=1.4
(2)参加反应的铁的物质的量为 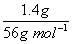 =0.025 mol,生成的FeSO4,与参加反应的铁的物质的量相等,所以c(FeSO4)= =0.025 mol,生成的FeSO4,与参加反应的铁的物质的量相等,所以c(FeSO4)= 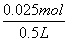 0.05mol· 0.05mol·
|