|
高一11月考化学试卷
时量:90分钟 总分:100分
可能用到的原子量:Zn 65 Cl 35.5 C 12 O 16 Na 23 N 14 Fe 56 Ca 40
K 39 S 32 Ba 137 H 1
一、选择题(共25小题50分,每题仅一个符合题意的选项)
1.下列溶液中含Cl- 浓度最大的是
A、10mL0.1mol/L的AlCl3 溶液 B、20mL0.1mol/LCaCl2 溶液
C、30mL0.2mol/L的KCl溶液 D、100mL0.25mol/L的NaCl溶液
2.某化合物易溶于水,但其水溶液不易导电,则该化合物是
A.弱电解质 B.强电解质 C.非电解质 D.不能确定
3.某化合物X,受热分解2X──A 2B 4C,测得生成物混合气体对氢气的相对密度为11.43,相同条件下X的式量为
A 11.43 B 22.86 C 80.01 D 140.02
4.已知单质X和Y相互反应生成X 2Y-2,对此变化,对此变化中有下列说法:
①X 被氧化,②X是氧化剂 ③X具有氧化性 ④XY中Y2-具有还原性,⑤Y是氧化剂,⑥XY中X2 具有氧化性,以下说法正确的是
A.①③⑥ B.①②③ C.②④⑥ D.①④⑤⑥
5.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.Cu(OH)2与盐酸,Cu(OH)2与醋酸 B.石灰石与硝酸反应,石灰石与盐酸
C.BaCl2溶液与Na2SO4溶液,Ba(OH)2溶液与H2SO4溶液
D.NaHCO3溶液与NaHSO4溶液,Na2CO3溶液与NaHSO4溶液
6.能够说明氯气比硫的氧化性强的反应是
A.CuCl2 H2S=CuS↓ 2HCl B. Cl2 H2S=2HCl S↓
C. FeS 2HCl=FeCl2 H2S↑ D.NaCl H2SO4 = NaHSO4 HCl↑
7.对四种无色溶液进行离子检验,实验结果如下,其中明显错误
A.K Na Cl- NO3- B. Cu2 NO3- OH - HCO3-
C.Na OH - Cl- Br- D. HCO3- K S2- Na
8.在xR2 yH O2=mR3 nH2O的离子方程式中,对系数m和R3 判断正确的是
A. m=4,R3 是氧化产物 B.m=1,R3 为氧化产物
C. m=2,R3 是还原产物 D. m=y,R3 为还原产物
9.把含少量一种其它氯化物的ZnCl2样品0.68g制成溶液,跟足量AgNO3溶液反应得1.10gAgCl沉淀,则样品中可能含有的杂质是
A.FeCl3 B.CaCl2 C. NaCl D. KCl
10.下列各组溶液,不用其他试剂,就可以将它们区别开的是
A.盐酸,氢氧化钠,碳酸钠,硫酸钠 B.盐酸,氢氧化钠,酚酞,硫酸铜
C.氢氧化钠,硫酸镁,碳酸钠,硫酸钠 D.氯化钡,硫酸钠,氯化钙,硝酸钙
11.钠与水反应时产生的各种现象如下:①钠浮在水面上,②钠沉在水底,③钠熔化成银白色的水球,④小球迅速游动逐渐减小,⑤发出嘶嘶的声音,⑤滴入酚酞后溶液显红色,其中正确的一组
A.①②③④⑤ B.全部 C.①③④⑤⑥ D.①③④⑥
12. FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时生成H2S2,H2S2类似于H2O2,易分解,实验室用稀盐酸制取H2S时,某学生误将FeS2颗粒当作FeS使用,当FeS2反应完后,不可能生成的物质是:
A H2S B S C FeS D FeCl2
13.下列各级中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是:
A Na2O2与CO2 B Na 和O2 C NaOH与CO2 D C 和O2
14.下列反应适用于实验室制备氧气的是:
① 高锰酸钾热分解 2KMnO4=K2MnO4 MnO2 O2↑
②硝酸铵热分解:2NH4NO3=4H2O 2N2↑ O2↑
③过氧化化钠与水反应:2Na2O2 2H2O=4NaOH O2↑
④ 二氧化氮热分解:2NO2=2NO O2
A ① B ①② C ①③ D ①③③
15. 在一定温度下,向饱和Na2SO4溶液中加入ag无水Na2SO4粉未,搅拌、静置后析出b gNa2SO4 ·10H2O晶体,则(b-a)是:
A原饱和溶液失去水的质量 B 原饱和溶液中减少的Na2SO4的质量
C原饱和溶液中失去水和Na2SO4的总质量 D析出的晶体中含有的Na2SO4质量
16. 将10g CO2和CO混合气体, 通过装有足量过氧化钠的干燥管,反应后干燥管的总质量增加了5.6g,则原混合气体中CO2的质量分数为:
A 32% B 44% C 56% D 88%
17. 某物质灼烧时焰色呈黄色,下列判断正确的是:
A 该物质一定含钠离子 B 该物质一定是钠的化合物
C 该物质一定是金属钠 D 不能确定是否含有钾元素
18.下列物质性质的比较正确的是:
A 热稳定性:Na2CO3>NaHCO3>H2CO3 B 熔点:K>Na>Li
C 溶解度:NaHCO3>Na2CO3 D 氧化性:Li <Na <K
19.下列物质既能跟H ,又能跟OH -反应的是( )
A.Na2CO3 B.NaHCO3 C.NaHSO4 D.MgCl2
20.在甲、乙、丙、丁四个烧杯内分别放入0.1mol的Na、Na2O、Na2O2和NaOH,然后加入100mL水,搅拌,使固体完全溶于水,则甲、乙、丙、丁溶液溶质的质量分数大小顺序是
A、甲<乙<丙<丁 B、丁<甲<乙=丙
C、甲=丁<乙=丙 D、丁<甲<乙<丙
21.下列说法正确的是(NA代表阿伏加德罗常数)
A 4.6gNa变为Na时失去0.2 NA个电子 B 32gO2所含的氧原子数为NA
C 18g水所含的电子数为NA D 11.2LCl2所含的氯原子数为NA
22.下列说法正确的是
A标准状况下,1mol水的体积约是22.4升 B 1molH2所占的体积约是22.4升
C标准状况下,6.02×1023个分子所占的体积约是22.4升
D标准状况下,28g氮气和CO的混合气体的体积约是22.4升
23. 40ml气体A2与120ml气体B2恰好完全反应,生成80ml气体X(体积均在同温同压下测的),则气体X的分子式为
A AB3 B AB C A3B D A2B3
24. 在密闭容器内有a mol CO和b mol O2点燃反应后,容器内碳原子数和氧原子数之比为
A a/b B a/2 C a/(a 2b) D a/2(a b)
25.标准状况下,a g气体A和b g气体B的体积相同,下列叙述正确的是
A A和B的分子个数比是1∶1 B A和B的密度之比为b∶a
C A和B的摩尔质量比是a∶b D A和B的摩尔质量比是b∶a
二、填空题(共25分)
26.有下列离子:K ,Mg2 ,Ba2 ,Cu2 ,Na ,CO32-,SO42-,OH -,NO3-,Cl-等按其在溶液中大量共存的原则,将上述离子等分成二组(要求每组不少于两种阳离子和两种阴 离子), 则两组分别是__①__, ② 。
27. Na2CO3固体中混有少量NaHCO3固体,除去的方法是 ①,化学方程式为 ②,.NaHCO3溶液中混有少量Na2CO3,除去的方法是 ③ 。 反应的离子方程式为 ④。NaOH溶液中混有少量Na2CO3除去的方法是⑤ ,反应的离子方程式为 ⑥。CO2中混有少量的HCl气体除去的方法是⑦。 反应的化学方程式为⑧ 。
28.A、B、C、D四种化合物的焰色反应,透过钴玻璃观察均为浅紫色.A、B、C和盐酸反应均生成D, B和C 反应可生成A,在B溶液中通入一种无色,无味气体时,适量时得A,过量时得C,写出分子式: A__B_ C__ D____
29. 碱金属的原子结构:其原子最外层电子数都为①个,原子半径②,可推断它们的原子有很强的③能力,因此Na、K、Rb、Cs与O2或H2O反应中最剧烈的是: ④。
301.7克NH3共有 ① mol电子,0.1molH2S共有约②个电子,同温同压下,同体积的NH3和H2S气体的质量比为 ③;同温同压下,同质量的NH3和H2S气体的体积比为 ④;同质量的NH3和H2S中氢原子的个数比为 ⑤。
三、实验题(共17分)
31、实验室用浓盐酸配制250mL0.1mol/L的盐酸溶液:
(1)配制250mL1mol/L盐酸溶液需要浓盐酸(密度为1.18g/mL,质量分数为36.5%)的体积为 。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度2—3cm处
32、工业产品碳酸钠中常混有氯化钠,测定碳酸钠质量分数的仪器装置图如图所示。供选用的试剂有:NaOH溶液、饱和石灰水、蒸馏水、浓硫酸、浓盐酸、稀盐酸、硝酸、碱石灰、无水氯化钙、无水硫酸铜、试样(含有少量氯化钠的碳酸钠)。请回答:
(1)各有关仪器中使用的药品及作用:
A.____,作用___ ; 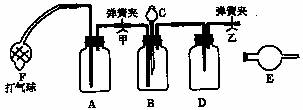
B._______,
C._______,
D._______,作用___ ;
E.___,作用____;F的作用____________。
(2实验步骤(到得到实验数据止):
(a) 称量:称试样质量及装有干燥剂的球形干燥管的质量,并纪录数据;
(b) ________________________________________________________;
(c) ________________________________________________________;
(d) ………………………………………………………………………….
四、计算题(共8分)
33、在溶有Na2CO3和Na2SO4的混合溶液中,加入过量的BaCl2溶液后,得到14.51克白色沉淀,用过量稀硝酸处理沉淀,沉淀量减到4.66克,并有气体放出。试计算:(1)原混合溶液含有的Na2CO3和Na2SO4的物质的量各多少?(2)产生的气体在标准状况下的体积为多少?
答卷部分
|
学校 班级 考号 姓名__________________________
uuuuuuuuuuuuuuu装uuuuuuuuuuuuuuu订uuuuuuuuuuuuu线uuuuuuuuuuuuuuu |  一选择题: 一选择题:
A D CDB,BBADB,DCACC,DDABB,ADACC。
二、26(4分)① OH- CO32- SO42- K Na ② Mg2 Cu2 Ba2 NO3- Cl-
27(8分)①加热②2NaHCO3=Na2CO3 H2O CO2↑
③ 通入足量的CO2 ④ CO32- CO2 H2O=2HCO3-
⑤ 加入适量的石灰水⑥ CO32- Ca2 =CaCO3↓
⑦ 将气体通过饱和的NaHCO3溶液 ⑧ NaHCO3 HCl=NaCl CO2↑ H2O
28(4分)A K2CO3B KOHC KHCO3D KCl
29(4分)① 1 ②递增③ 还原④ Cs
30(5分)① 1 ② 1.8NA ③ 1:2 ④ 2:1
⑤ 3:1
三、31(3分)⑴ 21.2ml ⑵ B-C-A-F-E-D
32(14分)⑴A NaOH溶液 作用 吸收空气中的CO2
B Na2CO3样品
C 稀H2SO4
D浓H2SO4 作用干燥产生的CO2
E碱石灰 作用吸收得到的CO2
F 作用 鼓入空气使产生的CO2被全部排出
⑵(b)打开弹簧夹甲、乙,按要求装入各处的试剂,再鼓入空气一段时间。
(c) 将干燥管接入系统的未端,打开分流漏斗的活塞,边鼓空气,直到充分反应完为止。
(d) 持续的鼓入空气一段时间后,再将干燥管的质量称出来,计好数据。求算结果。
四、计算题(8分)
Na2SO4:0.02mol Na2CO3:0.05mol 气体体积约为1.12升
|