|
高一上学期期末考试化学试卷
满分:100分 时间:1小时40分
说明:
1.本试卷分第I、II两部分,第I部分为选择题,第II部分为非选择题。
2.本试卷可能用到的相对原子质量:Mn—55 Ag—108 Cl—35.5 C—12 O—16 H—1
第Ⅰ卷(选择题,共40分)
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.目前,全球有16亿人有不同程度的缺碘现象,其中包括6亿儿童。科研表明,人的一生只要能摄入一小茶匙的碘就能正常发育,健康生活。目前预防缺碘的有效办法是食用含碘食盐。这种食盐含
A.单质碘(I2) B.碘化钠中化合态的碘(I-)
C.碘酸钠中的碘元素 D.氯化碘(ICl)中的碘元素
2.下列说法正确是的
A.常温常压下,22.4L氖气含有NA个氖原子
B.1molNa2O2固体跟足量CO2的气体完全反应转移NA个电子
C.将CO2通入漂白粉溶液中一定有沉淀生成
D.焰色反应属于化学变化
3.为了验证NaHCO3固体中是否含有Na2CO3,下列实验及判断中,正确的是 A.加热,观察是否有气体放出 B.溶于水后加石灰水,看有无沉淀
C.溶于水后加BaCl2溶液,看有无沉淀 D.加热后称量,看质量是否变化
4.将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为
A.5a/b mol/L B.10a/b mol/L C.b/5a mol/L D.a/b mol/L
5.在通常情况下,下列气体不能共存的是
A.H2、Cl2 B.H2、O2 C. H2、Br2 D.H2、F2
6.把CO2通入下列饱和溶液中,最终会有沉淀的是
A.CaCl2 B.Na2CO3 C.Ca(OH)2 D.NaNO3
7.下列各组物质互相作用时,生成物不随反应条件或反应物的量变化而变化的是
A.Na和O2 B.NaOH和CO2
C.NaHCO3和NaOH D.Na2CO3和HCl
8.可用离子方程式H OH-==H2O表示的化学反应是
A.CH3COOH NaOH==CH3COONa H2O
B.2HNO3 Mg(OH)2==Mg(NO3)2 2H2O
C.H2SO4 Ba(OH)2==BaSO4↓ 2H2O
D.2HCl Ba(OH)2==BaCl2 2H2O
9.下列微粒不具有还原性的是
A.H2 B.H C.Na D.CO
10.下列反应不属于氧化还原反应的是
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)  5KCl+KClO3+3H2O 5KCl+KClO3+3H2O
11.现有下列试剂:(1)氯水 (2)Br2水 (3)碘水 (4)碘酒 溶液,其中能使淀粉碘化钾溶液变蓝的是
A.除(3)外 B. 除(4)外 C. 除(2)外 D.全部
12.关于新制的氯水和久置的氯水,说法不正确的是
A.新制的氯水呈黄绿色,久置的氯水无色
B.新制的氯水漂白作用强,久置的氯水漂白作用很弱或消失
C.新制的氯水中没有氯离子,久置的氯水中才含有氯离子
D.新制的氯水中含氯气多,久置的氯水中含有极少量的氯气或不含氯气
13.既能导电又是电解质的是
A.蔗糖溶液 B.氢氧化钾溶液
C.熔融的氯化钠 D.硫酸溶液
14.根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是
①Cl2 2KI=I2 2KCl ②2FeCl3 2HI=I2 2FeCl2 2HCl
③2FeCl2 Cl2=2FeCl3 ④I2 SO2 2H2O=2HI H2SO4
A.Cl2>I2>Fe3 >SO2 B.Fe3 >Cl2>I2>SO2
C.Cl2>Fe3 >I2>SO2 D.Cl2>Fe3 >SO2>I2
15.下列物质中,不能与CO2反应的是
A.K2O2 B.RbHCO3 C.Na2O D.LiOH
16.在无土栽培中,配制内含0.5 molNH4CI,0.16 mol KCl, 0.24mol K2SO4的某营养液,若用KCl,NH4CI和(NH4)2SO4三种固体配制,则需此三种固体的物质的量分别为
A.0.40mol 0.50mol 0.12mol B.0.66mol 0.50mol 0.24mol
C.0.64mol 0.50mol 0.24mol D.0.64mol 0.02 mol 0.24mol
17.某同学在实验室用17.4g MnO2和50mL 8mol/L浓盐酸加热制Cl2,在常温常压下,该同学可制得Cl2
A.2.24L B.0.2mol C.7.1g D.无法计算
18.在标准状况下,将V L A气体(摩尔质量为Mg/mol)溶于0.1 L水中,所得溶液密度为d g·mL-1,则此溶液的摩尔浓度为
A. 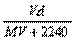 B. B. 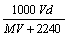 C. C. 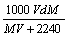 D. D. 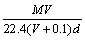
19.下列说法正确的是
A.标准状况下22.4L/mol就是气体摩尔体积
B.非标准状况下,1mol任何气体的体积不可能为22.4L
C.标准状况下22.4L任何物质都约含有6.02×1023个分子
D.1mol H2和O2的混合气体在标准状况下的体积约为22.4L
20.某温度下,将C12通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A.21:5 B. 11:3 C.3:1 D.4:1
第Ⅱ卷(非选择题,共60分)
二、非选择题(本题共7小题,共60分)
21.(4分)在标准状况下,4g H2,11.2L O2,1mol H2O中,所含分子数最多的是______,含原子数最多的是________,质量最大的是________,体积最小的是________。
22.(7分)标出下列反应的电子转移方向和数目,并填写有关内容:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
① 元素得电子, 元素被氧化。
②氧化剂与还原剂的物质的量比是 。
③若有7.3 gHCl被氧化,产生Cl2的质量为_______。
④离子方程式为: 。
23.(14分)A.B.C三种固体物质的焰色反应为黄色,分别跟水发生化学反应均得物质D的溶液;A跟水反应还有O2生成,B跟水反应还有H2生成,C跟水反应是化合反应:
(1)A为______________ B为______________ C为______________ D为______________
(2)由B生成A的化学方程式__________________________________________。
(3)由A变为D的化学方程式__________________________________________。
(4)由B变为D的化学方程式__________________________________________。
24.(12分)下列物质中都含有杂质(括号内为杂质),试选用合适的试剂和分离方法除去杂质。
填写下表: |
含杂质的物质 |
除杂试剂 |
分离方法 |
反应的化学方程式 | |
(1)Cl2(HCl) |
|
|
| |
(2)NaCl固体(NaI) |
|
|
| |
(3)NaNO3溶液(NaCl) |
|
|
| |