|
高一上学期期中考试化学卷2
化 学 试 卷
注意事项:本试卷分I、II两部分,考试时间90分钟,满分100分。
(本卷所需相对原子质量:H—1,O—16,C—12, N—14,Cl—35.5, S—32,Na—23,
Fe—56, K—39, Rb—85.5,Li—7,Ca—40,Cu—64,Cs—133)
第I卷(选择题 共125分)
一、单项选择题(本题共24小题,每小题只有一个选项符合题意,每小题2分,共48分)
1.1965年,我国科学家在世界上首次用化学方法合成的具有生物活性的物质是 ( )
A.核糖核酸 B.结晶牛胰岛素 C.叶绿体 D.血红素
2.下列物质中热稳定性最强的是 ( )
A.Ca(HCO3)2 B.H2CO3 C.CaCO3 D.NaHCO3
3.下列叙述中正确的是 ( )
A.虽然Cu能导电,但Cu是大量电解质
B.BaSO4虽然难溶于水,但BaSO4是强电解质
C.溶于水能电离出H 的化合物都是酸
D.阳离子只有氧化性,阴离子只有还原性
4.下列说法正确的是 ( )
A.化学反应中的能量变化,通常表现为热量的变化
B.反应物的总能量高于生成物的总能量时发生吸热反应
C.Ba(OH)2·8H2O与NH4Cl的反应是放热反应 ( )
D.木炭在氧气中的燃烧是吸热反应
5.将钠、钾分别投入相同质量的稀H2SO4中,反应结束后,二种溶液的质量仍相等而金属均无剩余,则投入的钠、钾的质量比为 ( )
A. 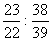 B. B. 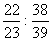 C. C. 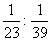 D. D. 
6.下列关于钾离子性质的叙述中正确的是 ( )
A.因极易被氧化,必须保存于煤油中 B.有银白色金属光泽
C.能置换出CaCl2溶液中的Ca D.焰色反应为紫色
7.根据下列三个反应的化学方程式,判断有关物质的还原性强弱顺序是 ( )
①I2 SO2 2H2O=H2SO4 2HI
②2FeCl2 Cl2=2 FeCl3
③2 FeCl3 2HI=2FeCl2 2HCl I2
A.I->Fe2 >Cl->SO2 B.Cl-> Fe2 > SO2> I-
C.Fe2 > I-> Cl-> SO2 D.SO2> I-> Fe2 >Cl-
8.在以下变化中,钠元素发发生了还原反应的是 ( )
A.Na2O2→Na2CO3 B.NaH→NaOH
C.NaCl→Na D.Na→Na2O
9.等质量的下列金属中,与足量的稀硫酸反应时,产生H2最多的是 ( )
A.锂 B.钠 C.镁 D.铝
10.下列各组中的两物质作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是 ( )
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.NaHCO3和NaOH
11.下列说法中,正确的是 ( )
A.失去电子多的还原剂,还原性就强
B.含最高价元素的化合物一定具有强氧化性
C.Fe2 的氧化性强于Cu2
D.某元素由化合态变为游离态(单质),则此元素可能是被还原,也可能是被氧化
12.已知反应:X Y=M N为放热反应,对该反应的下列说法中正确的是 ( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热反应就可发生
13.下列物质反应,最后有沉淀生成的是 ( )
A.NaHCO3溶液与石灰水 B.Na与Ba(NO3)2溶液
C.CO2与CaCl2溶液 D.过量CO2通入适量的石灰水中
14.下列反应中,不属于氧化还原反应的是 ( )
A.2CO O2 2CO2 B.CH4 2O2 CO2 2H2O
C.2KClO3 2KCl 3O2↑ D.2Fe(OH)3 △ Fe2O3 3H2O
15.在xR2 yH O2==mR3 nH2O的离子反应中,系数m的数值为 ( )
A.2x B.4 C.y/2 D.2
16.下列说法中正确的是 ( )
A.自然界中有游离态的铯
B.金属钾很活泼易被氧化,故应保存在煤油中
C.碳酸钠的俗名为小苏打,带10个结晶水的硫酸钠的俗名为芒硝
D.过氧化钠和氧化钠都是碱性氧化物
17.在ag水(足量)中投入bg某固体物质,完全溶解后,所得溶液的溶质质量分数为 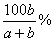 ,该固体物质是 ( ) ,该固体物质是 ( )
A.Na B.Na2O2 C.Na2O D.Na2CO3
18.下列物质中属于电解质的是 ( )
①蔗糖 ②铝 ③二氧化碳 ④硫酸钠 ⑤氢氧化钾
A.②④⑤ B.④⑤ C.③④⑤ D.①②③
19.在下列反应中,水仅作还原剂的是 ( )
A.2Na 2H2O=2NaOH H2↑ B.Cl2 H2O=HCl HClO
C.2F2 2H2O=4HF O2 D.2H2O2=2H2O O2↑
20.下列反应中能用离子方程式:H OH-=H2O表示的是 ( )
A.NaO溶液与盐酸反应 B.Fe(OH)3与硫酸反应
C.Ba(OH)2与硫酸反应 D.碳酸氢钠与氢氧化钠的溶液反应
21.下列离子方程式中正确的是 ( )
A.石灰石与盐酸反应CO32- 2H =CO2↑ H2O
B.硫酸与氢氧化镁反应2H 2OH-=2H2O
C.铁与稀硫酸反应2Fe 6H =2Fe3 3H2↑
D.碳酸钠与澄清石灰水反应Ca2 CO32-=CaCO3↓
22.下列离子能大量共存,且溶液为无色透明的是 ( )
A.Cu2 、Cl-、SO42-、K B.Mg2 、SO42-、K 、Cl-
C.H 、CO32-、Ca2 、Cl- D.NH4 、OH-、Cl-、Mg2
23.在H2SO3 2H2S=3S 3H2O的反应中,被氧化的元素与被还原的元素的质量比是( )
A.2:1 B.1:1 C.1:2 D.3:2
24.除去NaCl中含有的Ca2 、Mg2 、SO42-、HCO3-四种离子通常采用加入以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④HCl,每种试剂的加入都是过量的,最后溶液中只允许有H 、Na 、Cl-.则加入试剂的合理的操作顺序是 ( )
A.①②③④ B.④③②① C.③②①④ D.②④③①
二、不定项选择(本题共8小题,每小题有一个或两个正确答案,每小题2分,共16分)
25.关于碱金属单质的性质叙述错误的是 ( )
A.钠钾合金在常温下为液态
B.与水反应时都能生成碱和氢气
C.熔沸点随核电荷数增加而升高
D.还原性随原子电子层数的增加而增强
26.将质量比为1:1的一氧化碳和氢气组成的混合气体2.8克与足量的氧气充分反应后,立即将全部的燃烧产物通入足量的过氧化钠固体,固体质量增加 ( )
A.2.1克 B.2.8克 C.3.6克 D.7.2克
27.现有一块碱金属组成的合金2.5克,当投入水中完全反应后,收集到氢气0.2克,碱金属的可能组成是 ( )
A.锂和钠 B.锂和钾 C.钾和钅加 D.钅加 和铯
28.下列关于钅加 的叙述不正确的是 ( )
A.金属钅加 投入水中会发生爆炸式的反应。
B.钅加 是一种强还原剂,但是钅加 离子一定很稳定
C.钅加 可以在空气中燃烧,燃烧产物是Rb2O
D.若加热,RbOH可以分解为氧化钅加 和水蒸气
29.下列各组物质中,按由高到低或由大到小顺序排列的是 ( )
A.单质密度:Li、Na、 K、Rb、Cs
B.离子的氧化性:Li 、Na 、 K 、Rb 、Cs
C.金属还原性:Li、Na、 K、Rb、Cs
D.原子半径:Cs、Rb、K、Na、Li
30.下列离子方程式正确的是 ( )
A.碳酸氢钙溶液跟稀硝酸反应:HCO3- H ==CO2↑ H2O
B.澄清石灰水跟稀硝酸反应:Ca(OH)2 2H ==Ca2 2 H2O
C.向稀氨水中加入稀盐酸:NH3·H2O H ==NH4 H2O
D.碳酸钙溶于醋酸:CaCO3 2H == Ca2 CO2 H2O
31.下列关于Na2CO3和NaHCO3性质的比较中正确的是 ( )
A.对热稳定性:Na2CO3< NaHCO3
B.常温时溶解度:Na2CO3> NaHCO3
C.与稀盐酸反应产生气体的快慢:Na2CO3> NaHCO3
D.与澄清石灰水混合:Na2CO3反应,NaHCO3不反应
32.用一种试剂和必要的实验操作就能鉴别NaHCO3、NaCl、KCl、K2SO4四种物质,此试剂与实验操作是 ( )
A.盐酸、焰色反应 B.Ba(OH)2溶液、焰色反应
C.盐酸、加热 D.BaCl2溶液、焰色反应
第Ⅱ卷(非选择题,共36分)
三、填空题
33.(6分)在横线上填上适当物质的化学式,完成离子方程式(化学计量数不可改变)
(1) 3H ==Fe3
(2)CO2 ==CO32-
(3)HCO3- ==CO2↑
34.(4分)写出下列给出的物质之间反应的离子方程式
(1)碳酸氢钠溶液中加入足量的澄清石灰水
(2)纯碱溶液中加入氢氧化钡溶液
35.(9分)银白色固体A置于空气中逐渐变为B,后又逐渐变为C,最后变为D。将A点燃,火焰呈黄色,生成淡黄色的固体E。A、B、E均能与中性液体F反应生成C。且A还同时生成气体G,E还同时生成气体H。若点燃G和H的混合气体,可爆炸生成F。据此推断
(1)A、B、C、D、E、F的化学式分别为A 、B 、C 、
D 、E 、F 。
(2)写出E和F反应的化学方程式并用“双线桥”标出电子转移的方向和数目:
36.(8分)根据反应3Cl2 8NH3=6NH4Cl N2回答下列问题:
(1)该反应中氧化剂是 ,还原剂是 ,转移电子数为 ,
氧化剂与氧化产物的质量比为 ;
(2)当生成2.8克N2时,被氧化的物质是 克,被还原的物质是 克。
四、计算题:
37.(5分)加热27.4克碳酸钠的碳酸氢钠的混合物至质量不再变化,剩余固体的质量为21.2克,计算原混合物中碳酸钠的质量分数。(小数点后保留一位)
38.(4分)将ag钠溶于bg水中,cgNa2O溶于dg水中,mgNa2O2溶于ng水中,均得到质量分数为8%的溶液。(不用写计算过程)
(1)若c:m=31:39,则d:n
(2)若a=4.6g,则b= g
化学参考答案:
一、1.B 2.C 3.B 4.A 5.D 6.D 7.D 8.C
9.A 10.C 11.D 12.C 13.A 14.D 15.B 16.B
17.D 18.B 19.C 20.A 21.D 22.B 23.A 24.C
二、25.C 26.B 27.AB 28.CD 29.BD 30.AC 31.B 32.B
三、填空题
33.(1) Fe(OH)3 3H2O
(2) 2OH- H2O
(3) H H2O
34.(1)HCO3- Ca2 OH-=CaCO3↓ H2O
(2)CO32- Ba2 =Ba CO3↓
35.(1) Na、 Na2O、 NaOH、 Na2CO3、 Na2O2、 H2O
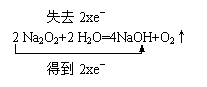

(2)
36.(1)Cl2 NH3 be- 213:28 (2)3.4 21.3
37.解:设原混合物中NaH CO3的质量为xg
 2NaHCO3 △ Na2CO3 H2O CO2 2NaHCO3 △ Na2CO3 H2O CO2
2×84 62
x 27.4-21.2=6.2
x=16.8(g)
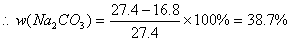
答:原混合物中碳酸钠的质量原数为38.7%
38.(1)1:1
(2)95.6
|