| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
(2)书写氯气分别与氢氧化钠、氢氧化钙反应的化学方程式及离子方程式: , , 3、漂白粉的主要成分是 ;有效成分是 ;漂白原理是(用方程式表示) ;漂白粉久置会失效,原理是 。 (二)基础训练 1、下列关于研究物质性质的方法和程序的论述中,正确的是 ( ) A、“方法”和“程序”这是两个不同的概念 B、“方法”和“程序”完全是一回事 C、“方法”和“程序”是毫不相干的两回事 D、“方法”和“程序”相互配合才能有效地完成研究物质性质的任务 2、下图是一种试验某种气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶盛的溶液是 ( )
A、浓硫酸 B、饱和食盐水 C、浓氢氧化钠溶液D、氢氧化钙悬浊液 3、下列化合物中,不能通过单质间化合直接制取的是 ( ) A、氯化铁 B、氯化铜 C、氯化钠 D、氯化亚铁 4、下列说法中不正确的是 ( ) A、氢气在氯气中燃烧产生苍白色火焰 B、氯水用于漂白表现了次氯酸的强氧化性 C、漂粉精是纯净物,其有效成分是次氯酸钠 D、漂粉精放入稀酸中可以提高漂白速度 5、关于氯水的叙述,正确的是 ( ) A、新制氯水中只含Cl2和H2O分子 B、新制氯水可使紫色石蕊试液先变红后褪色 C、=氯水和液氯所含成分完全相同 D、氯水久置后溶液的PH值将变小 6、潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的酸性溶液均能使有色布条退色,是因为它们都含有 ( ) A、氯气 B、次氯酸 C、次氯酸根 D、盐酸 7、实验探究活动中,属于实验报告内容的是 ( ) a.实验目的b.试剂和仪器c.实验现象d.结论及解释e.实验步骤 A、abc B、acd C、bce D、全都是 8、家用消毒液发生器是化学知识在日常生活中的“创新”应用。该发生器利用常见的精盐和自来水为反应物。通电时,发生器内电解槽里的极板上产生大量水泡。切断电源后所得的消毒液有强烈的杀菌能力,且对人体无害。溶液中发生的主要的反应为: 通电时:2NaCl 2H2O =2NaOH H2 Cl2 2NaOH Cl2 =NaCl NaClO H2O 则所得消毒液的有效成分是 ( ) A、NaCl B、Cl2 C、NaClO D、.HClO 9、将一粒金属钠和一块铜片分别盛在表面皿中放在实验桌上,研究它们在空气中的稳定性。就此回答下面的问题: (1)从研究物质性质基本方法的方面来说,采用的研究方法主要包括 。 (2)从研究物质性质基本程序的方面来说,其研究程序是 。 10、实验桌上有一瓶用毛玻璃片盖严的盛满氯气的集气瓶,如何闻其气味?
11、氯气溶于水中所得到的溶液叫做氯水。氯水呈 性,PH 7。若向新制氯水中滴加碳酸钠溶液,预计观察到的现象是 ;若向新制氯水中滴加硝酸银溶液,预计观察到的现象是 ,其理由是 。 12、某生应用下图所示方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
(1)该项研究(实验)的主要目的是 (2)浓硫酸的作用是 。与研究目的直接相关的实验现象是 (3)从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是 。请在图D处以图的形式表明克服事故隐患的措施。 13(选做)、用滴管将新制的饱和氯水慢慢滴入含酚酞的氢氧化钠稀溶液中,当滴到最后一滴时红色突然褪去,试回答下列问题: ⑴实验室保存饱和氯水的方法是 ⑵产生上述现象的原因可能有两种(简要文字说明) ① ② (3)简述怎样用实验证明红色褪去的原因是①或者②? 二、研究物质性质的程序、氯气(基础训练)答案: 1、 D2、B3、D4、C5、D6、B7、D8、C 9、(1)观察法、实验法、比较法、分类法(2)观察物质的外观性质——预测物质的性质——实验和观察——解释及结论 10、稍打开玻璃片,用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔 11、酸;< ;有气泡冒出;白色沉淀;氯气与水反应生成盐酸,盐酸电离出的氯离子与银离子结合生成白色的氯化银沉淀 12、(1)比较Cl2与HClO谁有漂白性(2)吸收气体A中的水;B内的布条不褪色,C内布条褪色 (3)氯气污染空气;措施如下图
13、(1)在阴凉处置于棕色试剂瓶中密封保存 (2) ①氯水与氢氧化钠反应生成两种盐,碱性减弱;②氯水过量后次氯酸的漂白性将溶液变成无色(3)向无色溶液中再滴加氢氧化钠溶液,若不再出现红色,应为原因②,若再出现红色,应为原因① 三、物质的量 (一)重要知识点回顾 1、“物质的量”这个概念十分重要,贯穿高中化学的始终,在化学计算中处于核心地位。 (1)请填写如下空白处: SHAPE \* MERGEFORMAT
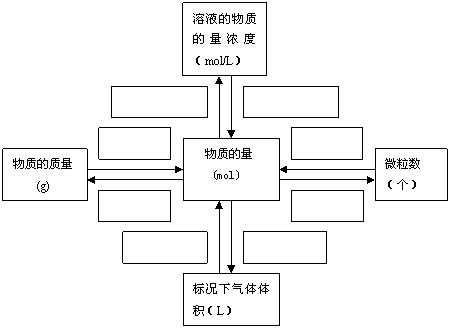 
2H2 O2 2H2O 从质量角度: 4g 32g 36g 从分子数角度: 2分子 1分子 2分子 从物质的量角度: 从标况下气体体积角度: 从任意相同条件气体体积角度: 2体积 1体积 2、 请以NaCl固体配制250ml0.5mol/L的NaCl溶液为例, 简述大致步骤
主要仪器: 误差分析(请填写如下空白处)
| 操 作 实 情
| 对溶液物质的量浓度的影响
| 称量前未调零点,天平指针偏向左边
|
| 称取药品时放在右边托盘上称量
|
| 容量瓶洗涤后未干燥
|
| 未洗涤溶解NaCl固体的烧杯
|
| 定容时眼睛处于仰视的位置
|
| 摇匀后发现凹液面的最低点低于刻度线,再加水至刻度线
| | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(二)基础训练
1、下列说法中,正确的是 ( )
A、1mol氢 B、1.5molH2O
C、2mol铁钉 D、3mol西瓜
2、下列说法中,不正确的是 ( )
A、1mol氯化钙中含有3mol离子
B、0.5mol氯气中含有1mol氯原子
C、4g甲烷和4g氧气所含的分子数相等
D、0.5g氢气与24.5g硫酸所含的分子数相等
3、物质的量相同的任何气体物质,相同的是 ( )
A、体积 B、 质量 C、摩尔质量 D.、分子数
4、下列叙述中,错误的是 ( )
A、在标准状况下,气体的摩尔体积约为22.4L/mol
B、在标准状况下,0.3molH2与0.7molN2组成的混合气体约为22.4L
C、非标准状况下,1molCO体积不可能约为22.4L
D、同温同压下,不同气体分子间的距离几乎相等
5、浓度为2mol/L的NaOH溶液的正确含义是( )
A、2L水中溶有80g的氢氧化钠
B、80g氢氧化钠溶于水配成的溶液
C、每升溶液中含有80g氢氧化钠
D、每2L溶液中含有80g氢氧化钠
6、将同体积同物质的量浓度的氯化钠、氯化镁、氯化铝三种溶液中的氯离子完全沉淀,则需同物质的量浓度的硝酸银溶液的体积比为 ( )
A、1:2:3 B、3:2:1 C、1:1:1 D、6:3:2
7、配制0.12mol/L的NaCl溶液250ml,不需要的仪器是 ( )
= 1 \* GB3 ①烧杯 = 2 \* GB3 ②250ml容量瓶 = 3 \* GB3 ③量筒 = 4 \* GB3 ④玻璃棒 = 5 \* GB3 ⑤胶头滴管 = 6 \* GB3 ⑥托盘天平
A、 = 3 \* GB3 ③ B、 = 2 \* GB3 ② = 6 \* GB3 ⑥ C、 = 1 \* GB3 ① = 3 \* GB3 ③ D、 = 1 \* GB3 ① = 4 \* GB3 ④
8、下列溶液中的氯离子浓度与50 mL1mol/L AlCl3溶液中的氯离子浓度相等的是 ( )
A、150mL1mol/L 氯化钠
B、75mL2mol/L氯化钙
C、150mL3mol/L 氯化钾
D、75mL2mol/L氯化铁
9、50 mL质量分数为35%,密度为1.24g/ml的硫酸中,硫酸的物质的量浓度为 ( )
A、0.044 mol/L B、0.44 mol/L C、4.4 mol/L D、44 mol/L
10、在标况下,与12克H2的体积相等的N2为 ( )
A、质量为12克 B、物质的量为6mol
C、体积为22.4L/mol D、物质的量为12mol
11、下列数量的各物质所含原子个数按由大到小顺序排列的是 a、0.5mol氨气 b、4g氦气 c、4℃9ml水 d、0.2mol磷酸钠
A、adcb B、dcba C、bcda D、adbc
12、相同质量的下列气体中,所含原子数最多的是 ( )
A、甲烷 B、氮气 C、一氧化碳 D、氧气
13、在容量瓶上无需标记的是 ( )
A、温度 B、刻度线 C、浓度 D、容积
14、将50mL0.1mol/LNaCl和50mL0.5mol/LCaCl2溶液混合后,若溶液的体积为二者之和,则混合溶液中氯离子的浓度为 ( )
A、1mol/L B、0.55mol/L C、0.67 mol/L D、2mol/L
15(选做)、4.实验室里需用480mL0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,操作正确的是 ( )
A、称取7.68g硫酸铜,加入500mL水
B、称取12.0g胆矾,配成500mL溶液
C、称取8.0g硫酸铜,加入500mL水
D、称取12.5g胆矾,配成500mL溶液
16(选做)、在同温同压下,A容器中的氧气和B容器中氨气所含的原子个数相同,则A、B两容器中气体的体积之比是 ( )
A、1:2 B、2:1 C、2:3 D、3:2
17、1molCO2的质量是一个CO2分子质量的 倍,1molCO2的质量与CO2的相对分子质量相比,两者 相同,但前者以 为单位,后者以 为标准。某质量CO2中含有1.204x1024个CO2分子,这些CO2的质量是 g,2molCO2中所含的氧原子数是 个。5molCO32-是 g,它和 molMg2 含有相同的质量,它和 gSO42-含有相同的离子数。
18、判断下列说法是否正确,如不正确,指出错误的原因。
⑴在标准状况下,1molH2O的体积约是22.4L
⑵1molH2的体积约为22.4L
⑶1molCO2和1molCO所含的分子数相同,所占的体积也相同
⑷在标准状况下,CO2的体积约为22.4L
⑸1molO2在20℃时体积一定大于22.4L
⑹1molO2和H2的混合气体在标准状况下,所占体积约是22.4L
⑺当某气体的体积为22.4L时,它一定处于标准状况下。
19、实验室用固体烧碱配制500mL0.1 mol/L氢氧化钠溶液。
⑴需称量 g的烧碱固体,它应该盛在 中进行称量
⑵配制过程中,不需要使用的仪器是
A、烧杯 B、量筒 C、玻璃棒 D、1000mL容量瓶
E、漏斗 F、胶头滴管 G、500mL试剂瓶
⑶根据实验的实际需要和⑵中列出的仪器判断,完成实验还缺少的仪器是 。
⑷在容量瓶内确定溶液体积的过程中,完成后期加入的那少量水的做法是
。
20、某温度下22%的硝酸钠溶液150 mL,加100g水稀释后浓度变成14%,求原溶液的物质的量浓度。
21(选做)、一定质量的液态化合物XY2,在一定质量的氧气中恰好完全燃烧,反应方程式为XY2(g) 3O2(g) ==XO2(g) 2YO2(g)。冷却后,在标准状况下,测得生成物的体积是672mL,密度是2.56g/L,则:
= 1 \* GB2 ⑴反应前氧气的体积是
= 2 \* GB2 ⑵化合物XY2的摩尔质量是
= 3 \* GB2 ⑶若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为 和
22(选做)、气体由双原子分子构成,它的摩尔质量为Mg/mol,该气体有mg,阿伏加德罗常数用NA表示,则:
⑴该气体的物质的量为
⑵该气体在标准状况下的体积为 (3)该气体在标准状况下的密度为
(4)该气体所含原子总数为
(5)该气体一个分子的质量为
(6)该气体溶于1L水中(与水不反应),其溶液中溶质的质量分数为
三、物质的量(基础训练)答案:
1、B 2、C 3、D 4、C 5、C 6、A 7、A 8、C 9、C 10、B 11、C 12、A
13、C 14、B 15、D 16、B
17、6.02X1023 数值 克 1 88 2.408x1024 300 12.5 480
18、(1)错 水在标况下的状态不是气体。1molH2O的体积不是22.4L
(2 ) 错。没有指明条件;标况下1molH2的体积约为22.4L
(3)错。1molCO2和1mo1CO只有在相同条件下体积才相同
(4)错。没有指明气体的物质的量。标况下1molCO2的体积约为22.4L
(5)错。没有指明压强。1molO2在20℃,101Kpa条件时的体积时大于22.4L
(6)正确。
(7)错。22.4L气体为1mol时其条件可为标准状况,还可为非标准状况。
19、⑴2.0 烧杯 ⑵D.E ⑶托盘天平、药匙、 500mL容量瓶⑷当加如蒸馏水距刻度线1至2厘米处时,改用胶头滴管逐滴加水,同时以平视式观察液面与刻度线的关系。当液面和刻度线相切时,立即停止加水
20、3mol/L
21、(1)672ml (2)76g/mol (3)C.S
22、.(1)m/M mol (2)22.4m/M L (3)M/22.4 g/L (4)1.204x1024m/M
(5)M/6.02x1023 g (6)(m/1000 m)x100%
《认识化学科学》综合练习
一、选择题(本题包括15个小题,每小题4分,共42分,每个小题有一个选项符合题意)
1、下列说法不正确的是 ( )
A、假说经过反复验证和修证,才发展成为科学的理论
B、模型一般可分为物体模型和思维模型
C、科学实验能解决化学学科的所有问题
D、研究物质的性质常运用观察、实验、分类、比较等方法
2、下列说法正确的是 ( )
A、物质的量可理解为物质的质量
B、物质的量就是物质的粒子数目
C、物质的量是量度物质所含微观粒子多少的一个物理量
D、物质的量的单位——摩尔只适合于分子、原子、和离子
3、某化学实验的尾气中含有较多的氯气,有毒。要吸收这些尾气,下列试剂中最合适的是 ( )
A、烧碱溶液 B、饱和石灰水 C、自来水 D、食盐水
4、分别与1molCl2发生反应,消耗质量最少的物质是 ( )
A、Fe B、Cu C、Mg D、Na
5、本身具有漂白性的是 ( )
A、HCl B、Cl2 C、HClO D、Ca(ClO)2
6、配制200mL1.5mol/L的NaCl溶液,用托盘天平称取氯化钠固体的质量是 ( )
A、17.55g B、17g C、18g D、17.6g
7、在标况下,2.24L NOx气体的质量为3.0g则x值为 ( )
A、4 B、3 C、2 D、1
8、在同温同压下,将由H2和Cl2组成的混合气体200mL引发化学反应,反应后的气体体积仍为200mL。下列对反应状况的判断中不正确的是 ( )
A、若反应后的气体有刺激性气味,则一定是氯气未完全反应
B、若反应后的气体没有颜色,则一定是氯气已完全反应
C、若反应后的气体略带黄绿色,则一定是氢气已完全反应
D、若反应后的气体遇水显漂白性,则一定是氯气未完全反应
9、对于相同质量的氧气和臭氧,下列说法中正确的是 ( )
A、分子数相同 B、原子数相同
C、标准状况下体积相等 D、标准状况下密度相等
10、写一个字消耗铅笔的质量约为1 mg。如果铅笔芯全部由石墨组成,则同一个铅笔字含有的碳原子数约为 ( )
A、7.224x1022个 B、6x1020个 C、5x1022个 D、5x1019个
11、酒精的分子式为C2H6O,在质量分数为46%的酒精水溶液中,酒精和水分子的个数比为 ( )
A、1:1 B、1:3 C、3:1 D、23:27
12、要配制500mL0.1 mol/L硫酸铜溶液,所取固体的质量和所选仪器是
固体的质量:
a.取12.5g结晶硫酸铜;b.取25g结晶硫酸铜;c.取25g无水硫酸铜。
仪器:
除烧杯、胶头滴管、玻璃棒、托盘天平和砝码、药匙外,还有:①500 mL量杯②500 mL烧瓶③500 mL容量瓶
A、a③ B、b③ C、c③ D、a①
13、下列说法不正确的是 ( )
A、磷酸的摩尔质量与6.02x1023个磷酸分子的质量在数值上相等
B、6.02x1023个氮分子和6.02x1023个氢分子的质量比等于14:1
C、32g氧气所含的原子数目为2x6.02x1023
D、常温常压下,0.5x6.02x1023个一氧化碳分子所占体积是11.2L
14(选做)、下列两种气体的分子数一定相等的是 ( )
A、质量相等密度不等的N2和C2H4
B、等体积的CO和C2H4
C、等温等体积的O2和N2
D、等压等体积的N2和CO2
15(选做)、有五瓶溶液分别是:①10mL0.6mol/L氢氧化钠水溶液②20mL0.50mol/L硫酸溶液③30mL0.40mol/L盐酸④40mL0.30mol/L醋酸溶液⑤50mL0.2mol/L蔗糖水溶液,以上各瓶溶液所含离子、分子总数的大小顺序是 ( )
A、①>②>③>④>⑤ B、②>①>③>④>⑤
C、②>③>④>①>⑤ D、⑤>④>③>②>①
二.填空题(本题包括4小题,共44分)
16、(10分)
⑴用经过准确称量的氢氧化钠固体配制250mL0.2mol/L的氢氧化钠溶液①在下列的实验仪器中,不必使用的是
A.托盘天平 B.50mL量筒 C.500mL容量瓶D.250mL烧杯E.胶头滴管 F.500mL试剂瓶
②除上述仪器中可使用的以外还缺少的仪器是 。它在该实验中的用途是 。
⑵要配制浓度约为2mol/L的氢氧化钠溶液100mL下列的操作正确的是
A.称取8克氢氧化钠固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8克氢氧化钠固体,放入100 mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL
C.称取8克氢氧化钠固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水到刻度线,盖好瓶塞,反复摇匀。
D.用100 mL量筒量取40 mL5 mol/L氢氧化钠溶液,倒入250 mL烧杯中,再用同一量筒取60 mL蒸馏水,在不断搅拌下,慢慢倒入烧杯中。
17、(14分)
⑴2molO3和3molO2的质量(填“相等”“不相等”或“无法判断”) ;分子数之比为 ;在相同条件下的体积之比为 。
⑵在标准状况下,15g由CO和CO2组成的混合气体,其体积为10.08L,则此混合气体中,CO和CO2的物质的量之比为 。
⑶在放电的作用下, O2可转化为O3,写出这种化学反应的方程式
。
⑷在常温常压下,O3也是一种气体,它与氯气具有相似的化学性质,可应用于对自来水的处理。O3在自来水中发挥的作用是 。
18、(4分)正常人体血液中葡萄糖(简称血糖,相对分子质量为180)的浓度3.61mmol/L--6.11m mol/L之间。测得某人1mL血液中含有葡萄糖1mg,他的血糖 (填“正常”或“不正常”)
19、(8分)有五种物质:①6gH2②0.5molCO2③1.204x1024个氯化氢分子④147g硫酸⑤92g
C2H5OH。它们的物质的量最大的是 ;
所含分子数最多的是 ;含原子个数最多的是 ;质量最大的是 。
20、(8分)将少量钠投入盛有硫酸铜溶液的烧杯中,试写出能观察到的现象及产生这些现象的原因。
⑴ ,
;
⑵ ,
;
⑶ ,
⑷ ,
。
三、计算题
21、(14分)2.30g金属钠分多次投入90.00g水中,所得溶液密度为1.08g/mL,求所得溶液中溶质的质量分数及物质的量浓度。
22(选做)、在标准状况下,1体积水能溶解700体积的氨气,得到密度为0.9g/ml的氨水,计算:
⑴此氨水的质量分数;
⑵此氨水的物质的量浓度。
《认识化学科学》综合练习
1、C 2、C 3、A 4、C 5、C 6、D 7、D 8、A 9、B 10、D 11、B 12、A
13、D 14、A 15、D
16、⑴①A.B.C②玻璃棒;搅拌,加快氢氧化钠的溶解;使液体沿着玻璃棒流入容量瓶内的刻度线以下。⑵AD
17、⑴相等;2:3;1:1;2:3⑵2:1⑶略⑷杀菌消毒
18、正常
19、①;①;⑤;④
20、⑴钠浮在液面上;钠的密度小于硫酸铜溶液的密度
⑵熔化成闪亮的小球;钠与水反应,放出热量使钠熔化
⑶四处游动,发出响声,最后消失;反应剧烈放出气体,发出响声并推动小球四处游动⑷溶液中产生蓝色絮状沉淀;钠与水反应生成氢氧化钠,与硫酸铜反应生成氢氧化铜蓝色絮状沉淀
21、4.34%;1.17mol/L
22、⑴34.7% ⑵18.4mol/L
| |