| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
第Ⅰ卷(选择题 共48分) 选择题答案栏
| 题号
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 答案
|
|
|
|
|
|
|
|
| 题号
| 9
| 10
| 11
| 12
| 13
| 14
|
| 答案
|
|
|
|
|
| | |||||||||||||||||||||||
Ⅱ卷(非选择题部分 共72分)
三、本题包括2小题,共18分
AUTONUM 15.(8分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出该反应的化学方程式并标出电子转移的方向和数目:
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
16.(10分)将2.3g金属钠投入到2.0mol·L-1 100mL的MgCl2溶液中,完全反应后,所得溶液中Na+物质的量浓度为 mol·L-1,Cl-物质的量浓度为 mol·L-1;所得气体在标准状况下所占的体积为 L;若继续向溶液中加入金属钠至沉淀完全,则产生沉淀的质量总和为 g;将生成的沉淀完全溶解于4.0 mol·L-1的盐酸中,则至少需要这种盐酸的体积为 L。
四、本题包括2小题,共24分
17.(12分)某待测液中可能含有Ag 、Fe3 、K 、Ba2 、NH4 等离子,进行如下实验:
第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
第四步:另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)分别写出第二步和第四步中所涉及反应的离子方程式:
第二步: ,第四步: ;
(2)待测液中一定含有 离子,一定不含有 离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程) ,
。
18.(12分)实验室制取氯气并检验其性质的装置如下。试回答下列问题:

(1)仪器A的名称是 ;
(2)写出实验室制取氯气的化学方程式 ;
(3)试管C中干燥的红花褪色的原因是 ;
(4)试管D中的现象是 ;
(5)试管F中浓H2SO4的作用是 ,
装置G为收集氯气的装置,则应选择(填代号) ;

(6)请写出装置E和H中反应的离子方程式:
E: ,
H: ;
五、本题包括1小题,共18分
19.(8分)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液,其中含有较多的NaCl、MgCl2、KCl、MgSO4和少量NaBr等物质):
|
空气 水蒸汽 |
|
Cl2 |
|
苦卤 |
|
Br2 |
|
Br2 |
|
Cl2 |
|
酸化 浓缩 |
|
反应② |
|
SO2 |
|
反应① |
|
反应③ |
|
溶液A |
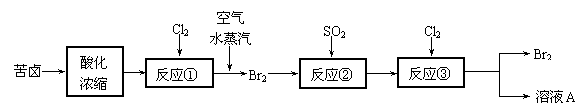
(1)反应①的离子方程式为 ;
(2)写出反应②的化学方程式 ;
(3)从反应③后的溶液中分离出单质溴的方法是 ;
(4)可以用BaCl2、NaOH、AgNO3三种溶液将溶液A中的Cl-、Mg2+、SO42-逐一沉淀下来,则所加三种溶液的顺序是 。
20.(10分) A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如下图所示:
|
氧化物B |
|
物质A |
|
单质X |
|
氧化物Y |
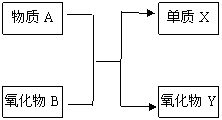 |
试写出符合下列条件的化学方程式
(1)若物质A为氧化物: ;
(2)若A为金属单质,B为金属氧化物: ;
(3)若A为金属单质,B为非金属单质: ;
(4)若A为非金属单质,X为金属单质: ;
(5)若A和X均为非金属单质: 。
六、本题包括1小题,共12分
21.(12分)将Na2O2加入到100mL AlCl3、MgCl2的混合溶液中,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。试回答下列问题:
|
n(产物)/mol |
|
n(Na2O2)/mol |
|
n(沉淀)/mol |
|
n(气体)/mol |
|
c |
|
0 |
|
x |
|
b |
|
a |
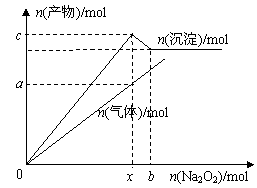 (1)若x=0.6,c=0.5;则a= ,原混合
(1)若x=0.6,c=0.5;则a= ,原混合
溶液中c(Cl-)= ;c(Al3+)= ;
(2)若保持溶液中c(Cl-)=9mol·L-1,通过改变AlCl3
和MgCl2的比例关系可以调整b的大小;若b越接近x
则原混合溶液中AlCl3的含量 (填“越大”、“越
小”或“保持不变”);b的变化范围是 。
高一化学
第Ⅰ卷(选择题 共48分)
题号
1
2
3
4
5
6
7
答案
C
B
C
B
D
A
D
题号
8
9
10
11
12
13
14
答案
A
BD
BC
A
AD
D
C
Ⅱ卷(非选择题部分 共72分)
|
得2e- |
|
失2e- |
 三、本题包括2小题,共18分
三、本题包括2小题,共18分
15.(8分)
(1)2Cl2 2Ca(OH)2=====CaCl2 Ca(ClO)2 2H2O (4分)
(2)Ca(ClO)2 (2分)
(3) Ca(ClO)2 CO2 H2O=====CaCO3↓ 2HClO (2分)
16.(10分,每空2分) 1.0 4.0 11.2 11.6 0.1
|
17.(12分,每空2分)(1)Ba2 SO42-=====BaSO4↓ NH4 OH-====NH3↑ H2O
(2)Ag 、Ba2 、 NH4 Fe3 (3)焰色反应 若透过蓝色钴玻璃,火焰呈紫色,则说明有钾离子。
|
(2)MnO2 4HCl(浓)====Cl2↑ MnCl2 2H2O(2分)
(3)氯气中含有水蒸汽(1分),氯气和水蒸汽反应生成HClO,HClO有漂白性。(1分)
(4)有白色沉淀生成(1分)
(5)干燥氯气(1分),甲(1分)
(6)Cl2 SO32- H2O====2H SO42- 2Cl-(2分)
Cl2 2OH-=====Cl- ClO- H2O(2分)
五、本题包括2小题,共18分
19.(8分)(1)Cl2 2Br-=====Br2 2Cl-(2分)
(2)SO2 Br2 2H2O=====2HBr H2SO4(2分)
(3)萃取并分液(2分)
(4)BaCl2、NaOH、AgNO3或NaOH、BaCl2、AgNO3(2分)
|
|
|
|
(4)H2 CuO====H2O Cu
|
六、本题包括1小题,共12分
21.(12分)(1)0.3 12 2 (各2分)
(2)越小(2分) (4.5,6.0)(4分)
| |