|
高一下期期末测试题(化学)
(考试时间:120分钟 满分:100分)
可能用到的原子量:H1 N14 O16 C12 Na23 Cl35.5 Mn55 Fe56 Ca40 S32 K39
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括10小题,每小题2分,共20分。每小题有一个选项符合题意)
1、下列情况可能引起大气污染的是( )
①煤的燃烧 ②工业废气的任意排放 ③燃放鞭炮 ④飞机、汽车尾气的排放
A、只有①② B、只有②④ C、只有①②③ D、都是
2、向KBr和KI的混合溶液中通入足量的Cl2后,再将溶液蒸干灼烧,最后剩余的物质的是
( )
A、KCl和KBr B、KCl C、KCl和I2 D、KCl和KI
3、下列物质能导电且为电解质的是( )
A、酒精 B、K2SO4晶体 C、熔化的NaCl D、Cu
4、相同条件下,下列各组中分子数相同的是( )
A、2LCO2与2LH2O B、34gNH3与4gH2
C、11.2LCO与0.5molO2 D、14gN2与32gNO2
5、已知钡的活性处于钾和钠之间,则下述说法可能实现的是( )
A、钡可从氯化钾溶液中置换出钾 B、钡可从氯化钠溶液中置换出钠
C、钡可从冷水中置换出氢而得到H2 D、在溶液中钡离子可氧化金属锌
6、下列各溶液中,Na 浓度最大的是( )
A、0.8L0.4mol/L的NaOH溶液 B、0.2L0.15mol/L的Na3PO4
C、1L0.3mol/L的NaCl溶液 D、0.1L0.5mol/L的NaCl溶液
7、下列物质所含的原子数与0.1molH3PO4所含原子数相等的是( )
A、0.2molH2O2 B、0.1molH2SO4 C、0.2molNaOH D、0.3molH2O
8、已知20g密度为ρg/mL的硝酸钙溶液中含有1gCa2 ,则NO3-的物质的量浓度为( )
A、ρ/400mol/L B、20/ρmol/L C、2.5ρmol/L D、1.25ρmol/L
9、下列叙述正确的是( )
A、碱金属与卤素单质的熔沸点均随核电荷数的增大而升高
B、卤素单质的密度均随核电荷数的增大而增大
C、卤素形成的氢化物稳定性随核电荷数增大而增大
D、碱金属都保存在煤油中
10、CO和H2的混合气体3g,和足量的氧气燃烧后,在150℃时将混合气体通过足量Na2O2后,Na2O2增重的质量为( )
A、3g B、1.5g C、6g D、无法确定
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一至二个选项符合题意,少选扣2分,多选、错选均不给分)
11、下列说法中不正确的是( )
A、Na2CO3比NaHCO3易溶于水 B、Na2CO3比NaHCO3稳定
C、石灰水能与Na2CO3反应,而不能与NaHCO3反应
D、与足量盐酸反应要得到相同质量的CO2,用NaHCO3比Na2CO3的质量要多
12、下列反应的离子方程式正确的是( )
A、钠与水反应:Na 2H2O===Na 2OH- H2↑
B、钠与CuSO4溶液反应:2Na Cu2 ===Cu↓ 2Na
C、NaHCO3溶洞与稀H2SO4反应:CO32- 2H ===H2O CO2↑
D、NaOH溶液与小苏打溶液反应:HCO3- OH-===CO32- H2O
13、设NA代表阿伏加德罗常数的值,则下列说法中不正确的是( )
A、28克铁与足量盐酸反应时失去的电子数为NA
B、在标准状况下,22.4L由氢气和氧气组成的混合气体中,所含有的分子总数为NA
C、体积为5.6L的CH4气体中所含氢原子数为NA
D、在常温常压下,金属从硫酸中置换出0.5molH2,转移的电子数为NA
14、在酸性溶液中能大量共存而且为无色透明的溶液( )
A、NH4 、Al3 、SO42-、NO3- B、K 、Na 、NO3-、SO42-
C、K 、MnO4-、NH4 、NO3- D、Na 、K 、HCO3-、NO3-
15、下列说法中,正确的是( )
A、氧化剂本身被还原,生成氧化产物
B、氧化剂是在反应中得到电子(或电子对偏向)的物质
C、还原剂在反应时所含元素的化合价降低
D、在一个反应中,氧化剂和还原剂可能是同一物质
16、下列有关Cl2的性质叙述中,正确的是( )
A、Cl2与Fe反应生成FeCl2 B、氯气可与所有的活泼金属反应
C、氯气可跟碱反应,所以氯气具有酸性 D、氯水经光照后有气泡放出,该气体是Cl2
17、不用其它试剂鉴别:①NaOH,②KCl,③Mg(NO3)2,④CuSO4等四种溶液,先直接鉴别出一种,再逐一鉴别其余物质,则正确鉴别顺序是( )
A、④①②③ B、①④③② C、①③④② D、④②①③
18、加热泪盈眶NH4HCO3固体,使产生的气体依次通过过量Na2O2的干燥管、浓H2SO4的洗耳恭听气瓶,最后得到的气体( )
A、O2 B、NH3 C、CO2 D、CO2和O2
19、标准状况下有①6.72LCH4;②3.01×1023个HCl;③13.6gH2S;④0.2molNH3。下列对四种气体的关系从小到大表示不正确的是( )
A、体积:④<①<②<③ B、密度:①<④<③<②
C、质量:④<①<③<② D、氢原子数:④<②<③<①
20、1个16O原子的质量为mg,若阿伏加德罗常数为NA,下列式子可表示12C原子质量的是( )
A、 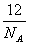 g B、 g B、 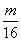 g C、 g C、 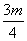 g D、mNAg g D、mNAg
第Ⅱ卷(非选择题50分)
三、填空题(本大题包括4小题,共23分)
21、(5分)在K2Cr2O7 14HCl===2KCl 2CrCl3 3Cl2↑ 7H2O反应中, 是氧化剂, 元素被氧化,HCl表现的性质是 ,电子转移的数目是 。
22、(8分)在新制氯水参加的反应中,有如下几种情况:
(1)向KBr溶液中加入氯水,氯水中起作用的主要身长微粒是 ,反应的离子方程式为: 。
(2)向AgNO3溶液中加入氯水,氯水中起作用的微粒是 ,反应的离子方程式为
(3)向氯水中滴入石蕊试液,溶液变红,起作用的微粒是 ,然后又褪色,起作用的微粒为 。
23、(4分)(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:_______________________________________。
(2)往澄清石灰水中滴入少量NaHCO3溶液,请写出此反应的离子方程式:_______________________________________________。
24、(6分):某温度下,a克KNO3晶体完全溶解在b克水中形成密度为dg/cm3的溶液,则溶液的质量分数为_____________,物质的量溶度为___________________________,若再加入CgKNO3晶体溶液恰好饱和,则该温度下KNO3的溶解度为_______________。
四、实验题(本题包括2小题,共13分)
25、(5分)有A、B、C、D、E五种无色溶液,只知它们是NaHCO3、K2CO3、NaOH、HCl、Ca(HCO3)2溶液,为了鉴别它们,各取少量进行如下实验:
① A与B混合无明显现象。
② B与C或D混合均有气体产生。
③ D与A或E混合均有沉淀生成。根据以上实验,推知A是______________,B是___________,C是__________,D是___________,E是__________。
26、(8分)配制0.1mol/L盐酸溶液500ml,请按操作顺序〔(1)、(2)、(3)……〕填写在操作前的括号内,并在横线上填写适当的仪器名称,操作方法和数字。
( )在盛盐酸的烧杯中注入蒸馏水(溶液体积少于500ml),用玻璃棒搅拌,使其均匀混合。
( )待稀释的盐酸冷却后,沿玻璃棒注入500ml的容量瓶中。
( )用量筒量取密度为1.19g/cm3,质量分数为37%的浓盐酸约(取整数)____________ml注入烧杯中。
( )往容量瓶中小心加紧蒸馏水至液面接近刻度____________cm处,改用_________加蒸馏水,使溶液____________________________恰好与刻度线水平相切。
五、计算题(本题包括2个小题,共14分)
27、(7分)取120克软锰矿(含MnO2),加足量的浓盐酸,如果其它成分不与浓盐酸反应,在标准状况下生成19.04升气体,求:
(1) 软锰矿的质量分数
(2) 被氧化的HCL的质量
28、(7分)取 NaHCO3、Na2CO3、NaCl混合物100g,加热到质量不再改变为止,剩下残渣84.5g。取8.45此残渣加入盐酸20g至气泡不再产生后,称得全部溶液质量为25。15g,求混合物中NaCl的质量分数。
高一化学期考答案
一、选择题(本题包括10小题,每小题2分,共20分)
1.D 2.B 3.C 4.B 5.C 6.D 7.A 8.C 9.B 10.A
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一至二个选项符合题意,少选扣2分,多选、错选不给分)
11.CD 12.D 13.C 14.AB 15.BD 16.B 17.A 18.A 19.AD 20.A
三、四、五题评分说明:1、方程式末配平,化学式书写错误一律不给分;
2、若有其它合理答案,酌情给分。
21、(共5分)K2Cr2O7(1分);Cl(1分;酸性和还原性(2分);6e(1分)
22、(共8分)Cl2(1分);2Br- Br2====2Cl- Br2(2分)
Cl-(1wv );Ag Cl-====AgCl↓(2分);H (1分)HCLO(1分)
23、(共4分)2H SO42- Ba2 2OH-====BaSO4↓ 2H2O (2分)
HCO3- Ca2 OH-====CaCO3↓ H2O (2分)
24、(共6分,每空2分) 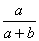 ×100%; ×100%; 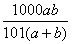 mol/L; mol/L; 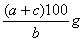
25、(共5分,每空1分)NaOH;HCl;NaHCO3;Ca(HCO3)2;K2CO3
26、(共8分)2,3,1,4,5;(3分) 4(2分) 2至3(1分);
胶头滴管(1分);凹液面最低处(1分)
27、(7分)解:设软锰矿中MnO 质量分数为X
MnO2 4HCL(浓)  MnCl2 Cl2↑ 2H2O (1分) MnCl2 Cl2↑ 2H2O (1分)
87g 22.4L
120g×X 19.04L
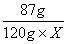 ==== ====  (3分) (3分)
解得:X=0.62=62% (1分)
被氧化的HCL的质量为: 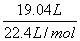 ×2×36.5g/mol===62.05g(2分) ×2×36.5g/mol===62.05g(2分)
答:略
28、(7分)解:设8.45g残渣中Na2CO3的质量为X
Na2CO3 2HCL===2NaCl H2O CO2↑ (1分)
106g 44g
X 8.45g 20g-25.15g
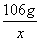 = = 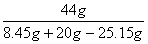 (3分) (3分)
解得:X=7.95g
原混合物中NaCl的质量为:(8.45g-7.95g)×10
=5g (1分)
混合物中NaCl的质量分数为: 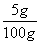 ×100%=5% (1分) ×100%=5% (1分)
答:略
|