| |
|
[组图]高一上学期化学单元测试4 非金属及其化合物
|
| 查询化高一上末的详细结果
|
|
[新课标人教版] 非金属及其化合物
注意事项:
1.本试卷包括第I卷(选择题)和第II卷(非选择题)两部分,满分100分。考试时间90分钟。
2.答第I卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂在答题卡上。答第II卷时,须将密封线内的项目填写清楚。
3.考生请将第I卷选择题的答案填涂至答题卡上;第II卷的答案,用蓝、黑钢笔或圆珠笔直接答在各题的相应位置上。考试结束后,只收答题卡和第II卷。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28
S 32 Cl 35.5 K 39 Fe 56
第Ⅰ卷(选择题,共44分)
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.下列污染现象主要与SO2有关的是 ( )
A.臭氧空洞 B.酸雨 C.光化学烟雾 D.温室效应
2.1777年舍勒在《火与空气》一书中指出:空气由两种性质不同的“火空气”和“浊空气”组成,其中“火空气”可以帮助燃烧,维持生命。下列物质不能与“火空气”发生反应的是 ( )
A.硫黄 B.沼气 C. 一氧化氮 D.烧碱溶液
3.下列物质中,同时含有氯分子、氯离子和氯的含氧化合物的是 ( )
A.氯水 B.液氯 C.氯酸钾 D.次氯酸钙
4.可以用来制取半导体材料(如大规模集成电路)的是 ( )
A.二氧化硅 B.粗硅 C.高纯硅 D.硅酸盐
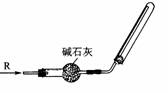 5.实验室可用右图所示装置干燥、收集某气体R,则R可能是 ( ) 5.实验室可用右图所示装置干燥、收集某气体R,则R可能是 ( )
A.SO2
B.NH3
C.HCl
D.Cl2
6.除去下列物质中的少量杂质(括号内的物质为杂质),所选用的试剂或方法不正确的是
( )
A.CO2(SO2):饱和NaHCO3溶液 B.NO(NO2):水
C.Fe(OH)3胶体(FeCl3):NaOH溶液 D.Na2CO3固体(NaHCO3):加热
7.下列符合化学实验“绿色化”的有 ( )
①在萃取操作的演示实验中,将CC14萃取溴水改为CC14萃取碘水
②在铜与浓硫酸反应的实验中,将铜片改为可调节高度的铜丝
③将实验室的废酸液与废碱液中和后再排放
A.①② B.①③ C.②③ D.①②③
8.下列物质的变化,不能通过一步化学反应完成的是 ( )
A.SiO2→SiF4 B.SiO2→Si C.SiO2→Na2SiO3 D.SiO2→H2SiO3
9.研究发现,NO在人体的血管系统内具有传送信号的功能,因而有“信使分子”誉称。则下列有关NO的说法正确的是 ( )
A.NO不属于大气污染物 B.NO能溶于水
C.NO易与空气中氧气化合 D.NO可用排空气法收集
10.“绿色化学”提倡,设计制备物质的方案时,要从经济、环保和技术等方面考虑,以下由铜制取硝酸铜的四种方案中,比较符合“绿色化学”概念且可行的方案是 ( )
A.Cu → Cu(NO3)2 B.Cu → CuO → Cu(NO3)2
C.Cu → CuCl2 → Cu(NO3)2 D.Cu → CuSO4 → Cu(NO3)2
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。若正确答案只有一个选项,错选、多选均不得分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得3分,但只要选错一个,该小题为0分。)
 11.A~D是含同一非金属元素的四种物质,相互之间有 11.A~D是含同一非金属元素的四种物质,相互之间有
如右图的转化关系,其中A是单质,D是最高价氧
化物的水化物,易溶于水。则A可能是 ( )
A.S B.Cl2 C.N2 D.Si
12.某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是 ( )
A.Na 、Mg2 、S2—、ClO— B.H 、Na 、SO42-、NO3—
C.K 、Ca2 、OH—、SO32— D.Na 、K 、Cl-、OH-
13.下列关于硫及含硫化合物的叙述正确的是 ( )
A.SO2的漂白原理与次氯酸相同
B.硫在空气中燃烧生成大量SO3
C.浓硫酸可以干燥H2、NH3、CO2等气体
D.常温下铝遇浓硫酸钝化,因此可用铝槽车储运浓硫酸
14.在粗碘中含有IBr和ICl,受热时,I2、ICl、IBr均可升华。在粗碘中加入一种物质后,再进行升华,可制得精碘,应加入的物质是 ( )
A.KI B.Zn C.KCl D.H2O
15.为检验Na2SO3溶液中不否含有Na2SO4应选用的试剂是 ( )
A.BaCl2溶液 B.BaCl2溶液、稀盐酸
C.BaCl2溶液、稀硝酸 D.BaCl2溶液、稀硫酸
16.某混合气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混合气体依次通过:(1)澄清石灰水(无浑浊现象),(2)Ba(OH)2溶液(出现白色沉淀),(3)浓硫酸(无明显变化),(5)灼热的氧化铜(变红),(6)无水硫酸铜(变蓝)。则可以判断混合气体中 ( )
A.一定没有CO2,肯定有H2 B.一定有H2、CO2,和HCl
C.一定有CO、CO2和水蒸气 D.可能有CO2、NH3和水蒸气
17.变压器的硅钢片含硅40%,其余为铁,则此硅钢片中硅和铁的原子个数比为4:3。向0.7g硅钢片中先加入20g5.0%的烧碱溶液,充分反应后,再向其中加入25 mL,10mol/L的浓盐酸,充分搅拌至反应结束,反应中共放出氢气多少克? ( )
A.0.0l B.0.055 C.0.02 D.0.045
18.如右图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是 ( )|
|
a中溶液 |
b中溶液 |
气体X | |
A |
饱和食盐水 |
KI-淀粉溶液 |
Cl2 | |
B |
酸性KMnO4溶液 |
稀品红溶液 |
SO2 | |
C |
饱和NaHS溶液 |
CuCl2溶液 |
HCl | |
D |
饱和NaHCO3溶液 |
石灰水 |
CO2 | |
第II卷(非选择题 共56分)
三、(本题包括两小题,共18分)
19.(8分)用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:
(1)计算机芯片的主要成分是 ;
(2)光导纤维的主要成分是 ;
(3)目前应用最多的太阳能电池的光电转化材料是 ;
(4)用作吸附剂、干燥剂、催化剂或催化剂载体的人造分子筛大多是一类称为 的化合物 ;
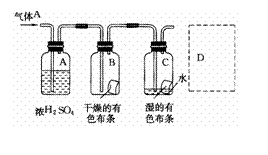 20.(10分)某生应用下图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题: 20.(10分)某生应用下图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
(1)该项研究(实验)的主要目的是
。
(2)浓H2SO4的作用是 。
与研究目的直接相关的实验现象是__ ______ 。
(3)从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是
。
请在图的D处以图的形式表明克服事故隐患的措施。
四、(本题包括两小题,共16分)
21.(8分)有3种可溶性离子化合物A、B、C,它们分别由阳离子NH  、Na 、Cu2 和阴离子OH-、S2-、SO 、Na 、Cu2 和阴离子OH-、S2-、SO  两两结合而成,取质量相等的A、B、C分别溶解于水,配成等体积的溶液,这3种溶液物质的量浓度大小的顺序是B>A>C根据题意回答下列问题: 两两结合而成,取质量相等的A、B、C分别溶解于水,配成等体积的溶液,这3种溶液物质的量浓度大小的顺序是B>A>C根据题意回答下列问题:
(1)推断出A是___________,B是___________,C是___________。
(2)写出A与B溶液混合发生反应的离子方程式
。
22.(8分)利用化学变化的递变规律,常可对某些物质的化学性质作出合理的推测,请判断下列各小题的推测是否合理,并说明判断的理由。
(1)已知红热的铜丝能在氯气中燃烧,推测红热的铁丝也能在氯气中燃烧。
(2)已知铁粉和硫粉加热条件下能发生反应,推测铜粉和硫粉在相同加热条件下也一定能发生反应。
(3)从二氧化硫通入Ba(OH)2溶液能产生白色沉淀的事实,推测二氧化硫通入BaCl2溶液也能产生白色沉淀。
(4)从2CO2 2Na2O2==2Na2CO3 O2↑的反应,推测二氧化硫也一定能发生反应:2SO2 2Na2O2==2Na2SO3 O2↑
五、(本题包括两小题,共22分)
23.(12分)已知A、B、C、D是单质,X、Y、Z是化合物,它们之间有如下转化关系:
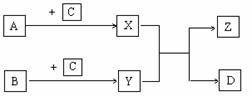
(1)若C、D为同一种物质,则:
= 1 \* GB3 ①化合物Z的组成元素 (用A、B、C …… 表示)。
= 2 \* GB3 ②反应X Y → Z D是否为氧化还原反应? (填“是”或“否”),其理由是 。
= 3 \* GB3 ③C元素在化合物X、Y中呈现的化合价,必定是在一种物质中呈正价,在另一种物质中呈负价。此结论是否正确 ;请写出有关反应的化学方程式来证明你的结论 。
(2)若B、D为同一种物质,写出反应X Y → Z D的化学方程式(若有多种情况,只写其中一种) 。
24.(10分)写出下列变化(石灰石→生石灰→消石灰→漂白粉)的有关反应化学方程式,并计算如果要制取508g漂白粉,一共需要含杂质20%的石灰石多少克?
(提示:本题建立总的关系式解答,较为方便。注意答题不能答到框外)
化学方程式:(1)
(2)
(3)
有关计算:
参考答案
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.B 2.D 3.A 4.C 5.B 6.C 7.D 8.D 9.C 10.B
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。若正确答案只有一个选项,错选、多选均不得分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得3分,但只要选错一个,该小题为0分。)
11.AC 12.D 13.D 14.A 15.B 16.B 17.B 18.B
三、(本题包括两小题,共18分)
19.(8分)(1)硅(或Si或单晶硅)(2)二氧化硅(或SiO2)(3)硅(或Si)(4)铝硅酸盐(或硅铝酸盐)(每空2分,共8分)
20.(10分)(1)比较Cl2与HClO谁有漂白性(2分)。
(2)吸收气体A中的水(2分);B内的布条不褪色,C内的布条褪色(2分)。
(3)Cl2污染空气(2分);措施如下图
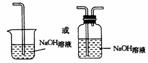 (2分) (2分)
四、(本题包括两小题,共16分)
21.(8分)(1)A、(NH4)2S;B、NaOH;C、CuSO4 (2)NH  +OH-=NH3·H2O +OH-=NH3·H2O
22.(8分)(1)合理;因为铁的还原性比铜强。(2分)
(2)不合理;因为铜的还原性比铁弱。(2分)
(3)不合理;因为二氧化硫通入氢氧化钡溶液产生白色沉淀的原因是,SO2 2OH-=SO32- H2O,然后Ba2 SO32-==BaSO3↓,而氯化钡溶液不存在和二氧化硫反应的大量的OH-。(2分,其它合理的解释也可)
(4)不合理(或不一定合理);因为二氧化硫有还原性,过氧化钠有强氧化性,过氧化钠可能会将二氧化硫氧化。(2分)
五、(本题包括两小题,共22分)
23.(12分)(1) = 1 \* GB3 ①一定含有A、B两种元素,可能含有C元素(2分)。
= 2 \* GB3 ②是(2分);X和Y是化合物,而D为单质,反应过程中必有化合价变化,所以是氧化还原反应(2分)。
= 3 \* GB3 ③不正确(2分);2Na2O2 2CO2=2Na2CO3 O2↑(2Na2O2 2H2O=4NaOH O2↑)(2分)
(2)CuO CO = Cu CO2(2分)
 24.(10分)① CaCO3 CaO CO2 (1分) 24.(10分)① CaCO3 CaO CO2 (1分)
②CaO H2O =Ca(OH)2 (1分)
③2Cl2 2Ca (OH)2 =CaCl2 Ca(ClO)2 2H2O (1分)
解:设需要含杂质20%的石灰石x g
2CaCO3 ~{Ca(ClO)2 CaCl2} (2分)
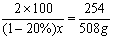 (3分) (3分)
x=500g (2分)
|
 20.(10分)某生应用下图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
20.(10分)某生应用下图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
 (2分)
(2分)