|
苏教版高一化学下学期复习试题
高一 ( )班 学号 姓名
AUTONUM 1.X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
A.HX B.H2X C.XH3 D.XH4
AUTONUM 2.若ⅡA族某元素原子序数为x,那么原子序数为x 1的元素可能位于
A. = 8 \* ROMAN VIII族 B.IB族 C.ⅡB族 D.ⅢB族
AUTONUM 3.下列分子中所有原子都满足最外层为8个电子结构的是
A.BF3 B.CCl4 C.H2O D.PCl5
4.下列气态氢化物中最不稳定的是
A. SiH4 B. CH4 C. H2O D. HCl
5.据报道,氢燃料电池公交汽车已经驶上北京街头。下列说法正确的是
A.电解水制取氢气是理想而经济的制氢方法
B.发展氢燃料电池汽车不需要安全高效的储氢技术
C.氢燃料电池汽车的使用可以有效减少城市空气污染
D.氢燃料电池把氢气和氧气燃烧放出的热能转化为电能
6.下列说法正确的是
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
7.共价键、离子键、金属键(金属离子与自由电子间的作用)、分子间作用力都是粒子间的作用力,含有以上两种作用力的晶体是
A.SiO2 B.CO2 C.NaCl D.Na
8.利用相关数据作出的推理或判断不正确的是
A.用键能大小的数据,可判断分子的稳定性
B.用原子半径的数据,可推断元素的主要化合价
C.用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来
D.用溶解度数据,可推测能否将一些液体混合物用萃取的方法分离开来
9.在常温常压下呈气态的化合物,降温使其固化得到的晶体属于
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
10.已知离子方程式:5X— XO3— 6H =3X2 3H2O,若X为主族元素,据此判断:X元素的最高化合价为
A. 1 B. 4 C. 5 D. 7
11.下列说法中不正确的是
A.X Y=M N为放热反应,可推知X和Y的总能量一定高于M和N的总能量
B.1mol SO2的键能总和大于1mol硫和1 mol氧气的键能之和
C.由C(石墨)=C(金刚石);△H= 1.9 kJ·mol-1可知,金刚石比石墨能量低
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
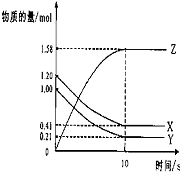 12.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示: 12.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
下列描述正确的是
A、反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B、反应开始到10s,X的物质的量浓度减少了0.79mol/L
C、反应开始到10s时,Y的转化率为79.0%
D、反应的化学方程式为:X(g) Y(g)  Z(g) Z(g)
13.利用合成气(H2+CO)生产汽油、甲醇和氨等已经实现
了工业化,合成气也可转化成醛、酸、酯等多种产物。下列表述不正确的是
A.以合成气为原料的反应都是化合反应
B.改变合成气中CO与H2的体积比,可以得到不同产物
C.从合成气出发生产液态烃或醇类有机物是实现“煤变油”的有效途径
D.以合成气为原料的反应产物中可能有不饱和烃或水
14.利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
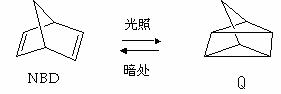
; △H = -88.62 kJ·mol-1
以下叙述不正确的是
A.NBD的化学能比Q的化学高
B.NBD和Q互为同分异构体
C.NBD能发生加成反应而Q不能发生加成反应
D.NBD不能使酸性高锰酸钾溶液褪色而Q能
15.用 A 、B- 、C 2- 、D、E、F、G 和 H分别表示含有 18个电子的八种微粒(离
子或分子),请回答:
(1)A元素是 ___ 、B 元素是 ___ 、C 元素是 ____ (用元素符号表示)。
(2)D 是由两种元素组成的双原子分子,其分子式是 ____ 。
(3)E 是所有含 18 个电子的微粒中氧化能力最强的分子,其分子式是 。
(4)F 是由两种元素组成的三原子分子,其分子式是 ,电子式是 ________。
(5)G 分子中含有 4 个原子,其分子式是 ___ 。
(6)H 分子中含有 8 个原子,其分子式是 _____ 。
16.物质在下列变化过程中克服的是:①分子间作用力 ②共价键 ③离子键。(填序号)
(1)冰融化 ,(2)液溴挥发 ,(3)电解熔融NaCl制Na ,
(4)H2S分解生成S和H2 ,(5)碘升华 。
17.工业上用乙烯和氯气为原料经下列各步合成聚氯乙烯(PVC):
反应 ①、③ 的化学方程式反应类型分别为
__________________________________、____________________
__________________________________。____________________
18.可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
 (1)试管a中需要加入浓硫酸、冰醋酸 (1)试管a中需要加入浓硫酸、冰醋酸
和乙醇各2 mL,正确的加入顺序入
操作是
(2)为防止a中的液体在实验时发生暴沸,
在加热前可采取的措施是
(3)实验中加热试管的目的是:
①
②
(4) 试管b中加有饱和Na2CO3溶液 ,其作用是
(5)反应结束后,振荡试管b静置,观察到的现象是
 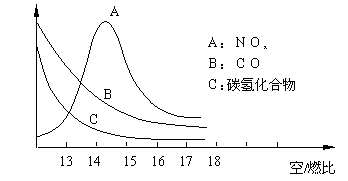 19.稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如下图所示。 19.稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如下图所示。
稀薄燃烧技术除能节约能源外,还
具有的优点是
(填一项)。排放到大气中的NOx
会导致酸雨、 等
环境问题(填一项)。
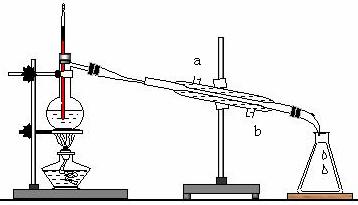 20.右图所示的是实验室 20.右图所示的是实验室
的实验,图中有 2个明显的错误:
(1)
(2)
实验中使用温度计的目的是
,
实验中冷凝水从 (填a、b)
侧进入。在 60 ~ 150 ℃收集得
到的馏分的主要成分为 。
21.二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。
请填写下列空白:
(1) 与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式是: 。
(2) 二甲醚可由合成气(CO H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是: 。
(3) 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上发生反应的物质是: 。
22.有U、W、X、Y 4种元素:U单质常温下为双原子分子,其氢化物水溶液呈碱性; Y的单质在W2中燃烧的产物可使品红溶液褪色;X的单质是一种金属,X和W元素形成的化合物X3W4具有磁性。请回答下列问题:
(1)U的单质分子的结构式为 ;Y元素在周期表中的位置是 。
(2)W元素形成的同素异形体的晶体类型可能是 。
(3)U、W、X、Y 4种元素中有一种明显不同于其他三种的是
15.(1)K Cl S (2) HCl (3)F2 (4)H2S 电子式略
(5)PH3 (6)C2H6
16. ① ① ③ ② ①
17.CH2=CH2 Cl2→CH2ClCH2Cl 加成
  n CH2=CHCl→ [CH2-CHCl]n n CH2=CHCl→ [CH2-CHCl]n
18.(1)乙醇、浓硫酸、冰醋酸 在a中放入少许碎瓷片
(2)加快乙酸乙酯的生成速率 有利于乙酸乙酯的蒸汽逸出。
(3)冷凝酯蒸气,吸收乙酸、乙醇,降低酯在水中的溶解度
溶液分上下层,上层为乙酸乙酯
19.减少CO、碳氢化合物的排放量 光化学烟雾
20.蒸馏石油 (1)温度计插入液面 (2)烧瓶中未放碎瓷片
测量馏分温度,以便收集馏分 b 汽油
21.(1)CH3CH2OH (2)2CO 4H2→CH3OCH3 H2O
(3)二甲醚
22. (1)N≡N 第三周期ⅥA族
(2)分子晶体 X
|