| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
1.当今化学界关注的热点之一C60,它可以看成是金刚石的()。
|
|
试写出(1)(2)(3)步反应的化学方程式。
第二节 硅和二氧化硅
1.二氧化硅是酸酐的原因是()。
A.它溶于水得相应的酸
B.它对应的水化物是可溶性强酸
C.它与强碱反应只生成盐和水
D.它是非金属氧化物
2.下列试剂的存放方法,正确的是()。
A.氢氧化钠、纯碱以及水玻璃溶液要存放在带磨砂玻璃塞的试剂瓶中
B.氢氟酸盛放在棕色试剂瓶
C.液溴盛放在带橡胶塞的试剂瓶中
D.氯水盛放在棕色细口瓶中
3.地壳中含量第一和第二的两种元素形成的化合物,不具有的性质是()。
A.熔点很高
B.是酸酐,与水反应生成对应的酸
C.可与生石灰反应
D.与碳在高温下反应可制取两元素中的一种单质
4.第ⅣA元素R,在它的化合物R(OH)n中,其质量分数为0.778,在它的另一种化合物R(OH)m中,其质量分数为0.636。
(1)试求n和m的值:n=___________,m=___________。
(2)试求R的相对原子质量___________。
5.“9·11”,美国世贸大厦轰然倒下。在清理废渣中,人们发现有很多石棉。石棉是一种具有压伸强度大,柔韧性强、耐热、耐火焰、耐酸和耐碱的腐蚀,而且价格低廉的硅酸盐。石棉有毒,能使人患肺癌。
(1)有一种石棉叫做矿青石棉,其化学式为Na2Fe5Si8H2O24。写成氧化物形式的化学式为___________。
(2)三硅酸镁是一种胃病患者常用的抑酸剂,试写出三硅酸镁(Mg2Si3O8·nH2O)中和胃酸(主要成分为盐酸)的化学反应方程式___________。
(3)生成玻璃的原料之一是正长石KAlSi3Ox,x是___________,以氧化物形式表示为___________。
第三节 无机非金属材料
1.在玻璃、水泥工业生产中,都需要的原料是()。
A.石灰石
B.纯碱
C.粘土
D.石英
2.碳化硼(B4C3)陶瓷硬度大、熔点高,具有化学惰性。据此判断,下列不能作为碳化硼陶瓷用途的是()。
A.作耐磨材料
B.作润滑材料
C.制切削工业
D.制钢化玻璃
3.磷酸钙是陶瓷,也是一种新型无机非金属材料,它可用于制造人造骨骼,这是利用这类材料的()。
A.耐高温的特性
B.电学特性
C.光学特性
D.生物功能
4.氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃时反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是___________(填序号)。
A.制气轮机叶片
B.制有色金属
C.制永久性模具
D.制造柴油机
(2)写出N的原子结构示意图___________,根据元素周期律知识,请写出氮化硅的化学式___________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式___________。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为___________。
全章训练
1.下列物质的晶体中,不存在分子的是()。
A.二氧化硅
B.二氧化硫
C.二氧化碳
D.二氧化氯
2.某二价金属碳酸盐和碳酸氢盐的混合物跟足量盐酸反应,消耗H 和产生CO2的物质的量之比为6∶5,该混合物中碳酸盐和碳酸氢盐的物质的量之比为()。
A.1∶1
B.1∶2
C.1∶3
D.1∶4
3.某无色混合气体可能含有CO2、CO、H2O(g)、H2中的一种或几种,依次进行如下连续处理(假定每步处理均反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清的石灰水时,溶液变得浑浊。由此可以确定原混合气体中()。
A.一定含有CO2、H2O,至少含有H2、CO中的一种
B.一定含有H2O、CO,至少含有CO2、H2中的一种
C.一定含有CO、CO2,至少含有H2O、H2中的一种
D.一定含有CO、H2,至少含有H2O、CO2中的一种
4.高岭土的组成可表示为Al2Si2Ox(OH)y,其中x,y的数值分别是()。
A.7,2
B.5,4
C.6,3
D.3,6
5.某些保健品中含有锗(Ge)元素,它位于元素周期表的第四周期ⅥA族,有关锗的叙述正确的是()。
A.二氧化锗具有强氧化性
B.锗的金属活动性比铝强
C.锗可以生成化学式为Na2GeO3的盐
D.锗是金属,可代替铜、铝制作电的导线
6.在SiO2+3C ![]() SiC+2CO的反应中,氧化剂与还原剂质量之比是()。
SiC+2CO的反应中,氧化剂与还原剂质量之比是()。
A.35∶60
B.60∶36
C.1∶2
D.1∶3
7.根据碳族元素的相似性和递变性、一般性和特殊性的知识,判断下列说法中正确的是()。
A.CO2为弱氧化剂,而PbO2为强氧化剂
B.CO2和PbO2都是弱氧化剂,CO和PbO都是还原剂
C.Sn(OH)4可与NaOH反应,但不与盐酸反应
D.Ge单质的熔点介于Si、Pb之间,是半导体材料
8.如图1,已知:
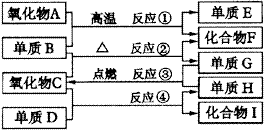
图1物质转化关系
①单质E可作为半导体材料。
②化合物F是不能生成盐的氧化物。
③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
(1)化合物F是___________。
(2)化合物I是___________。
(3)反应③的化学方程式___________。
(4)反应④的化学方程式___________。
9.在一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线如图2所示。试回答:
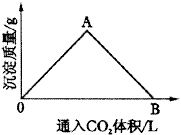
图2 沉淀质量与CO2气体体积关系
(1)OA段曲线和AB段曲线所表示的反应方程式是:
OA___________;AB___________。
(2)A点时已参加反应的CO2和Ca(OH)2的物质的量之比为___________。
(3)B处溶液中存在浓度较大的两种离子是___________和___________(填离子符号)。将B处生成的溶液煮沸,可见到的现象是___________。
参考答案
第一节 1.A 2.D 3.C、D 4.B
5.(1)GeO2+4HCl ![]() GeCl4+2H2O
GeCl4+2H2O
(2)GeCl4+3H2O ![]() H2GeO3↓+4HCl
H2GeO3↓+4HCl
(3)GeO2+2H2 ![]() Ge+2H2O
Ge+2H2O
第二节 1.C 2.D 3.B 4.(1)n=2,m=4 (2)119
5.(1)Na2O·3FeO·Fe2O3·8SiO2·H2O
(2)Mg2Si2O8·nH2O+4HCl=2MgCl2+3SiO2+(n+2)H2O
(3)8 2KAlSi3O8——→K2O·Al2O3·6SiO2
第三节 1.A 2.B、D 3.D 4.(1)A、C、D
(2)
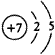 Si3N4
Si3N4
(3)Si3N4+12HF ![]() 3SiF4+4NH3
3SiF4+4NH3
(4)3SiCl4+2N2+6H2 ![]() Si3N4+12HCl
Si3N4+12HCl
全章训练 1.A 2.B 3.D 4.B 5.C 6.C 7.A、D 8.(1)CO (2)HF (3)2H2+O2 ![]() 2H2O
2H2O
(4)2F2+2H2O ![]() 4HF+O2↑
4HF+O2↑
9.(1)Ca(OH)2+CO2 ![]() CaCO3↓+H2O
CaCO3↓+H2O
CaCO3+CO2+H2O ![]() Ca(HCO3)2
Ca(HCO3)2
(2)1∶1 (3)Ca2 和HCO3- 生成白色沉淀
| |