|
(时间为45分钟)
可能用到的原子量有:H─1 C─12 N─14 O─16 Na─23 Al─27 S─32 Cl─35.5 K─39 Ca─20
= 1 \* ROMAN I卷(选择题)
一、选择题(共20小题,每题3分,共60分,每小题只有一个选项符合题意)
1.以下互为同素异形体的是
A.金刚石与石墨 B.氯气和液氯
C.CO与CO2 D. 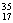 Cl与 Cl与 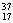 Cl Cl
2.属于同分异构体的是
A.O2和O3 B.2H2和3H2
C.H2O与H2O2 D.C2H5COOH与CH3COOCH3
3.下列化学式可表示一个分子的是
A.SiO2 B.NH4Cl C.CCl4 D.C
4.下列物质的分子中,不含共价键的是
A.NaCl B.Cl2 C.HCl D.NaOH
5.在下列有关晶体的叙述中错误的是
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高 D.稀有气体的原子能形成分子晶体
6.下列各组物质各自形成的晶体,均属于分子晶体的化合物是
A.NH3,Na,C4H10 B. PCl3,CO2,H2SO4
C.SO2,SiO2,P2O5 D. CCl4,Na2S,H2O2
7.碳的三种同位素12C、13C、14C的原子,下列各项对三种原子均不同的是 【B】
A.核电荷数 B.中子数 C.电子层数 D.元素种类
8.在核电荷数为1~20的元素中,最外层电子数和电子层数相等的元素共有 【A】
A.3种 B.4种 C.5种 D.6种
9.核电荷数为16的元素和核电荷数为4的元素的原子相比较,前者的下列数据是后者的4倍的是 【AD】
A.电子数 B.最外层电子数 C.电子层数 D.最内层电子数
10.下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O B.NH3 C.Cl2 D.NaCl
11.与氢氧根具有相同质子数和电子数的微粒是
A.F- B.Cl- C.NH3 D.NH4
12.下列微粒中:① 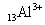 ② ② 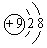 ③ ③ 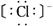 ④ ④ 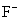 ,其核外电子数相同的是 ,其核外电子数相同的是
A.①②③ B.②③④ C.①②④ D.①③④
13.元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为
A.XY2 B.X2Y3 C.X3Y2 D.XY2
14.在周期表中,金属元素和非金属元素的分界线附近能找到
A.制农药的元素 B.制催化剂的元素
C.制半导体的元素 D.制耐高温合金材料的元素
15.某元素的最高正价与负价的绝对值之差为6,该元素的离子跟与其核外电子排布相同的离子所形成的化合物是
A.NaF B.KCl C.NaCl D.KF
16.元素性质呈周期性变化的原因是
A.相对原子质量逐渐增大 B.核电荷数逐渐增大
C.核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
17.下列叙述中, 错误的是 【A】
A.原子半径:Cl>S>O B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr D.酸性:HClO4>H2SO4>H3PO4
18.某元素X的最高价含氧酸的化学式为HnXO2n-2,则在某气态氢化物中,X元素的化合价为 A.-(12-5n) B.-(12-3n)
C.-(6-3n) D.-(10-n)
19.不能用来比较元素的非金属性强弱的依据是
A.元素最高价氧化物的水化物酸性强弱 B.元素单质熔沸点的高低
C.元素气态氢化物的稳定性 D.非金属单质间的相互置换
20.X、Y、Z三种元素,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数目相同,又知三种元素原子最外层电子数目总和为14,而质子数目总和为28,则3元素为
A.N、P、O B.N、C、Si C.B、Mg、Al D.C、N、P
= 2 \* ROMAN II卷(非选择题)
21.(2分)用电子式表示下列物质:
硫化钠:_________; CO2:_________;
22.(14分)下表是元素周期表的一部分,回答下列问题:
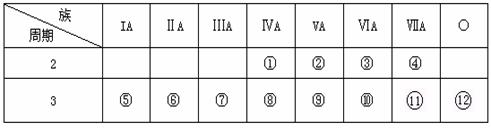
(1)写出①、②两种元素的名称____ , ____。
(2)写出⑧、⑨两种元素的符号____ , ____。
(3)在这些元素中,________(用元素符号填写,下同)是最活泼的金属元素;________是最活泼的非金属元素;________是最不活泼的元素。
(4)这些元素的最高价氧化物的对应水化物中________酸性最强;________碱性最强;能形成两性氢氧化物的元素是________。
(5)从⑤到 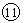 的元素中,________原子半径最小。 的元素中,________原子半径最小。
(6)比较⑤与⑥的化学性质,________更活泼,试用实验证明此现象(简述操作、现象和结论)
23.(8分) 有A、B、C、D四种元素,最高正价依次为1、4、5、7,其核电荷数按B、C、D、A顺序增大。已知B的次外层电子数为2,C、D、A原子次外层电子数均为8,C、D原子的电子层数相同 ,A原子的核外电子数不超过20,则A为 ,B为 ,C为 ,D为 .
24.(10分)在MgCl2溶液中滴入少量的NaOH溶液有 产生,继续加入NaOH溶液直到过量,现象是 。在AlCl3溶液中滴入少量NaOH溶液有 产生,反应的离子放程式是 ,继续加入NaOH溶液直到过量,现象是 反应的离子放程式是 。通过上述实验说明NaOH、 Mg(OH)2、Al(OH)3的碱性强弱的顺序是
25.(6分)已知A、B两种元素,A能形成的最高价氧化物为A2O,其中A的质量分数为74.19%;B元素能形成气态氢化物为H2B,B的最高价氧化物中B的质量分数为40.00%。通过计算和推理回答A、B各是什么元素,并分别指出A、B在周期表中的位置。
|