|
学年度第一学期期中检测高一化学试卷
共30题 共100分,时间90分钟
可能用到的相对原子质量:Cl-35.5 Na-23 O-16 H-1 S-32 C-12 Ba-137
(第Ⅰ卷)选择题共50分
一、选择题(共15小题,每题2分,计30分,每小题只有一个正确答案)
1.下列常用实验仪器中,不能直接用于混合物的分离或提纯的是( )
A.分液漏斗 B.普通漏斗 C.蒸馏烧瓶 D.容量瓶
2.下列常用实验仪器中,具有物质的质量或体积的测量功能的是( )
A.试管 B.烧瓶 C.冷凝管 D.量筒
3.拟通过加入适量的化学试剂,采用恰当的分离混合物的方法,除去某溶液里溶解着的杂质,下列做法中不正确的是(括号内的物质为杂质)( )
A.NaCl溶液(BaCl2)—加Na2SO4溶液,过滤。
B.KNO3溶液(AgNO3)—加NaCl溶液,过滤。
C.NaCl溶液(碘)—加汽油,分液。
D.KNO3溶液(碘)—加四氯化碳,分液。
4.下列实验事故处理的方法中,不正确的是( )
A.不慎把浓硫酸沾在手上,立即用干布试去,再用水冲洗
B.不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液
C.如果汽油、煤油等可燃物着火,应立即用水扑灭
D.酒精灯不慎碰翻着火,应立即用湿布盖灭
5.下面是有关厨房中的常见操作或者常见现象,其中不属于氧化还原反应的是( )
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气[主要成分为甲烷(CH4)]为炒菜供热量
C.牛奶久置变质腐败
D.把1mL饱和三氯化铁溶液逐滴加入20mL到沸水中,边加边振荡
6.下列分离或提纯物质的方法正确的是( )
A.用蒸馏法进行海水淡化
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4和BaCO3
D.用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
7.下列物质都能导电,其中属于电解质的是( )
A.NaCl的溶液 B.铁丝 C.稀硫酸 D.熔融的NaOH
8.下列基本反应类型中,一定是氧化还原反应的是( )
A.复分解反应 B.置换反应 C.分解反应 D.化合反应
9.下列分散系最稳定的是( )
A.悬浊液 B.乳浊液 C.胶体 D.溶液
10.下列反应中都有水的参加,其中水既不做氧化剂,又不做还原剂的氧化还原反应是( )
A.2Na2O2+2H2O=4NaOH+O2↑ B.CaO+H2O=Ca(OH)2
C.2Na+2H2O=2NaOH+H2↑ B.C+H2O=CO+H2
11.下列实验仪器中,常用于物质分离的是( )
①容量瓶 ②漏斗 ③试管夹 ④蒸馏烧瓶 ⑤分液漏斗 ⑥滴管
A.①④⑤ B.②④⑤ C.③④⑥ D.①②⑥
12.将V L HCl气体(标准状况)溶于水制得1000mL盐酸溶液,则该盐酸的物质的量浓度为( )
A.V /22400mol/L B.1000 V /22.4mol/L C. V /22.4mol/L D. V /11.2mol/L
13.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950mL,111.2g B.500mL,117g C.1000mL,117g D.任意规格,111.2g

A.酸性 B.碱性 C.氧化性 D.还原性
15.瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,则此时甲烷与氧气的体积比为( )
A.1:4 B.1:2 C.1:1 D.2:1
二、选择题(共10小题,每小题2分,计20分,每小题有1-2个正确答案,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给1分,选错一个该小题不给分。)
16.今有一种固体化合物x,x本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物x的说法中,正确的是( )
A.x一定为电解质 B.x可能为非电解质 C.x只能是盐类 D.x可以是任何化合物
17.下列实验操作中,正确的是( )
A.配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B.配制1mol·L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
C.配制0.1mol·L-1H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
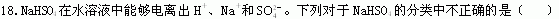
A.NaHSO4是盐 B.NaHSO4是酸式盐 C.NaHSO4是钠盐 D.NaHSO4是酸
19.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L CO2所含的原子数为1.5NA
B.常温常压下,48g O3含的氧原子数为3NA
C.标准状况下,22.4L H2中所含原子数为NA
D.标准状况下,1L 水所含分子数为NA
20.下列溶液中氯离子数目与50mL 1mol·L-1的AlCl3溶液中氯离子数目相等的是( )
A.150mL 1mol·L-1的NaCl B.75mL 2mol·L-1的NH4Cl
C.150mL 3mol·L-1的KCl D.75mL 2mol·L-1的CaCl2
21.能用H++OH-=H2O表示的是( )
A.NaOH溶液和CO2的反应 B.Ba(OH)2溶液和稀H2SO4的反应
C.NaOH溶液和盐酸反应 B.CaCO3和稀H2SO4的反应
22.下列各组气体或溶液用括号内试剂加以鉴别,其中合理的是( )
A.二氧化碳、一氧化碳、甲烷(新制的澄清石灰水)
B.氧气、氢气、氮气(炽热的氧化铜粉末)
C.氯化钠、硝酸银、碳酸钠(稀盐酸)
D.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
23.在某无色透明的酸性溶液中,能共存的离子组是( )

24.能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与盐酸的反应OH-+H+=H2O
B.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca++2H2O
C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.碳酸钙溶于稀盐酸中CaCO3+2H+=Ca2++H2O+CO2↑
25.下列溶液中的Cl-浓度与50mL 1mol·L-1 MgCl2溶液中的Cl-浓度相等的是( )
A.150mL 1mol·L-1 NaCl溶液 B.75mL 1mol·L-1 CaCl2溶液
C.150mL 2mol·L-1 KCl溶液 D.75mL 1mol·L-1 AlCl3溶液
三、填空题(计46分)
26.(5分)自然界中的物质多数是以混合物的形式存在,下面是混合物的分离和提纯,请填空:
(1)除去NaCl固体中混有的少量CaCO3,所进行的实验操作依次为:( )、( )、蒸发、结晶。
(2)除去KCl溶液中的 ,依次加入的溶液为(填溶质的化学式):( )、( )、( )。
27.(16分)实验室中需要配制500mL 0.10mol·L-1的NaOH溶液,就该实验回答下列问题。
(1)(每空3分)用托盘天平称量NaOH固态( )g。称量NaOH固体需注意以下两个问题:①因为NaOH具有腐蚀性,所以称量时,需注意选择( )盛装NaOH固体;②称量必须迅速,目的是( )
(2)(每空1分)实验所需要的仪器除托盘天平、药匙外,还有容量瓶规格是:( ),还有( )、( )、( )、( )。
(3)(2分)下列操作对所配制的溶液浓度没影响的是( )
A.称量时已观察到NaOH吸水
B.将烧杯中溶解后的溶液注入容量瓶,然后再添加蒸馏水至刻度线
C.摇匀定容后,用胶头滴管向容量瓶中加蒸馏水至刻度线
D.配制溶液前用蒸馏水润洗容量瓶
28.(每个离子方程式2分,其余每空1分,共12分)

甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子( )、( )、( )。乙厂的废水中含有另外三种离子。
对于该两厂的废水,可采取下列两种方法来处理。
(1)如果在废水中加一定量( )(选填:活性炭或铁粉),可以发生置换反应,离子方程式是( ),并且能够回收其中金属( )(填写金属元素符号)。
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式:
; 。
经过滤后的废水主要含( ),可用来浇灌农田。
29.阅读材料,回答问题。(本题共13分)
(1)常见的大气污染分为一次污染和二次污染。二次污染指的是排入环境中的一次污染物在物理、化学因素或生物作用不发生变化,或与环境中的其它物质发生反应生成新污染物,如:2NO+O2=2NO2,则二氧化氮就是二次污染物,由NO2导致的污染就是NO的二次污染。下列物质:(1)CO2 (2)NO (3)HCL (4)CO中,不会导致二次污染是 (3分)
(2)汽车尾气(含CO、SO2和NO等)是城市空气的污染源之一,治理方法之一是在汽车尾部装一个“催化转化器”,使CO与NO反应生成可参与大气生态循环无毒气体,并促进二氧化硫转化。回答:
①汽车尾气中污染空气的主要物质是 。(3分)②写出一氧化碳与一氧化氮反应化学方程式 。(2分)③使用“催化转化器”缺点是在一定程度上提高了空气的酸度,其原因是 。(3分)④控制城市空气污染源的方法有( )A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具(2分)
四、计算题(4分)
30.取一定量的Na2CO3和Na2SO4混合物溶液与过量盐酸反应,生成2.016L CO2(标准状况下),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33g。试计算混合物中Na2CO3和Na2SO4的物质的量分别为多少?
|